Source: http://www.tulane.edu/~wiser/protozoology/notes/malaria.html
Malaria on ollut ja on edelleen aiheuttanut paljon ihmisten sairastuvuutta ja kuolleisuutta. Vaikka tauti on hävitetty useimmissa lauhkean vyöhykkeen, se on edelleen endeeminen suuressa osassa tropiikissa ja subtropics. Neljäkymmentä prosenttia maailman väestöstä elää endeemisillä alueilla. Epidemiat ovat tuhonneet suuria populaatioita ja malaria on vakava este taloudellista kehitystä monissa kehitysmaissa. On arvioitu 300-500 miljoonaa tapausta kliinisen taudin vuodessa kanssa +1,5-+2.700.000 kuolemantapausta. Osa varhaisin tunnettu lääketieteen kirjoitukset Kiinasta, Assyria, ja Intia kuvaile malaria kaltainen ajoittainen kuume. Hippokrates, “isä lääke, on yleensä hyvitetään ensimmäisen kuvauksen kliinisten oireiden 500 BC, yli 2000 vuotta ennen loinen kuvattiin (taulukko). [Katso myös Wikipedia artikkeli “Historia malaria”.]
| Historialliset kohokohtia | ||
| 500_BC | Hippocrates | Kliinisiä oireita |
| 1880 | Laveran | Veri vaihe |
| 1898 | Ross | Hyttynen siirto |
| 1948 | Garnham | Maksa vaihe |
- Elinkaari
- Kliiniset ilmentymät
- Patogeneesi ja aivomalaria
- Epidemiologia ja valvonta
- Diagnoosi
- Kemoterapia ja lääkeresistenssin
Malaria aiheuttaa suvun jäsenistä Plasmodium. Plasmodium lajit ovat Apicomplexa (katso yleiskuvaus Apicomplexa) ja näytteille heteroxenous elinkaaren joihin selkärankaisisäntään ja niveljalkaisten vektori. Selkärankaisten isäntiä ovat: matelijat, linnut, jyrsijät, apinoita ja ihmisiä. Plasmodium lajit ovat yleensä isäntä erityisiä ja vektori erityisiä että jokaisen lajin vain tartuttaa rajallinen määrä isäntiä ja vektorit. Neljä erillistä laji tartunnan ihmisissä: P. falciparum, P. vivax, P. ovale ja P. malariae. (Katso sivu lajien eroista.) Lajit eroavat, niin niiden morfologia, yksityiskohdat elinkaarensa, ja niiden kliiniset oireet.
Elinkaari
Ihmisen ja muiden nisäkkäiden Plasmodium lajeja välittyvät anopheline hyttysiä. Loinen ruiskutetaan syljen aikana hyttynen ruokinta ja ensimmäinen läpikäy kierroksen merogony maksassa sen jälkeen useita kierroksia merogony erytrosyytteihin. Gametogony alkaa sisällä punasolujen selkärankaisen isännän ja saadaan päätökseen hyttynen jossa sporogony tapahtuu. Tämä elinkaari esittelee yleisiä piirteitä muiden Apicomplexan loisten ominaista suvuton replikaatiota ja muodostumista invasiivisen vaiheiden tyypillinen apikaalinen organelles.
Maksa vaihe. Ihmisen infektio alkaa, kun itiöiden injektoidaan syljen aikana hyttynen ruokinta. Itiöt anna verenkiertoelimistön ja 30-60 minuutin tunkeutuu maksasolujen. Isäntäsolu merkintä, kuten kaikissa Apicomplexa, helpotetaan apikaalisella organelles. Sen jälkeen valtaavat maksasolut loinen käy läpi suvuton replikointi. Tämä replikatiivista vaihetta kutsutaan usein exoerythrocytic (tai pre punasolujen) schizogony. Schizogony viittaa replikoituvaan prosessi, jossa loinen läpi useita kierroksia ydin- jako ilman sytoplasmisen jako seuraa orastava tai segmentointi, jolloin muodostuu jälkeläiset. Jälkeläisiä, kutsutaan merotsoiiteista, vapautuu verenkiertoelimistöön seuraavat repeämä vastaanottavan hepatosyyttien. (Katso elinkaari kuva.)
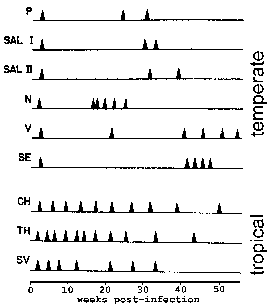
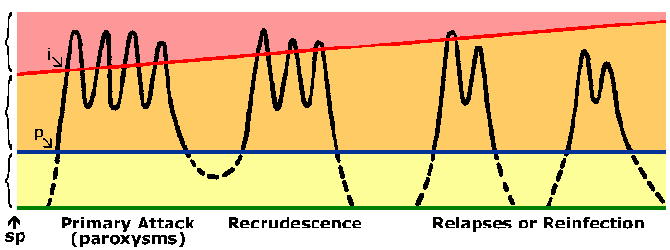
P. vivax ja P. ovale jotkut itiöiden eivät heti suoriteta suvuton lisääntymään, mutta anna lepotilassa vaiheeseen kutsutaan hypnozoite. (Kuitenkin muutamia kysymyksiä siitä P. ovale, esiintyy hypnozoite vaiheessa on nostettu. Katso Richter et al, 2010, Parasitology Research 107: 1285). Tämä hypnozoite voidaan aktivoida ja niitä schizogony myöhemmin johtaa uusiutumisen. Uusiutuminen on tietty merkitys suhteen malariaa ja viittaa uudelleenaktivointi infektion kautta hypnotsoiitteihin. Uudelleen puhkeaminen käytetään kuvaamaan tilannetta, jossa parasitemia laskee alle havaittavien tasojen ja sitten myöhemmin nousee patentin parasitemiaan. Mielenkiintoista, eristettyjen kantojen lauhkeilla alueilla on taipumusta pidemmän latenssiaika välillä ensisijainen infektio ja ensimmäinen uusiutuminen kuin kannat trooppisilla alueilla, joilla jatkuva lähetys (kuva).
Verta vaiheessa. Merotsoiitit vapautuvat tartunnan maksasoluja hyökätä punasolujen. Merotsoiitit tunnistavat spesifisiä proteiinien pinnalla punasolujen ja aktiivisesti tunkeutua solun samalla tavalla kuin muita Apicomplexan loisia. (Katso lisätietoja mekanismi isäntäsolun invaasion.) Kun olet syöttänyt punasolujen loinen käy läpi troofisena ajan seuraa suvuton replikointi. Nuoret trofotsoiittivaihe kutsutaan usein renkaan muoto, koska sen morfologia Geimsa-värillä tahrimat veritahrat. Koska loinen kasvaa kooltaan tämä “ring” morfologia katoaa ja sitä kutsutaan trofotsoiittivaihe. Aikana trofia aikana loinen syö isäntäsolun sytoplasmaan ja hajoaa hemoglobiinin aminohapoiksi. A-tuote hemoglobiinin ruoansulatusta on malaria pigmentti, tai hemozoin. (Katso muistiinpanoja elintarvikkeiden ontelon Plasmodium.) Nämä kullanruskeita mustaan rakeita on pitkään tunnustettu Tunnusomaista veren vaiheen loiset.
Nuclear jako merkitsee loppua trofotsoiittivaihe vaiheessa ja alussa skitsontti- vaiheessa. Punasolujen schizogongy koostuu 3-5 kierrosta (riippuen lajit) ydinvoiman replikaation seuraa orastava prosessi. Myöhäisessä vaiheessa skitsontit jossa yksittäiset merotsoiitit tullut havaittavaa kutsutaan segmentoijia. Isäntä punasolujen repeämät ja vapauttaa merotsoiittien. Nämä merotsoiitit hyökätä uusien punasolujen ja aloittaa toisen kierroksen schizogony. Veri-vaihe loiset sisällä isäntä yleensä tehdään synkroninen schizogony. Samanaikainen repeäminen tartunnan punasolujen ja samanaikainen vapautuminen antigeenejä ja jätteiden selittää kuumeilua paroxysms liittyy malariaan. Veri vaihe schizogony P. falciparum eroaa muista ihmisen malariaparasiitti kyseisessä trophozoite- ja skitsontti–tartunnan punasolujen kiinni kapillaari endoteelisolujen ja ei löydy ääreisverenkierron. Tämä sitomista liittyy aivojen malaria. (Katso elinkaari kuva.)
Seksuaalinen vaiheessa. Vaihtoehtona schizogony joitakin loiset tehdään suvullinen kierto ja terminaalisesti erilaistua joko mikro- tai macrogametocytes. Tekijöitä mukana induktioon gametocytogenesis eivät ole tiedossa. Kuitenkin sitoutuminen seksuaalisen vaiheen aikana tapahtuu suvuttomien punasolujen sykli edeltää välittömästi gametocyte kokoonpanoissa. Tytär merotsoiitit tästä skitsontti- kehittyy joko kaikki suvuton muodoissa tai kaikki seksuaalisen muodoissa. Gametocytes eivät aiheuta patologia ihmisen isäntä ja häviää verenkierrosta jos ei tarttunut hyttysen.
Gametogeneesiin, joissa muodostuu mikro- ja macrogametes, indusoituu kun gametocytes niellään hyttynen. Nieltynä hyttynen, The microgametocyte läpi kolme kierrosta ydin- lisääntymään. Nämä kahdeksan ytimiä sitten olla liitetty flagelloilla ilmeneviä elin microgametocyte. Tämä prosessi on helposti havaittavissa valomikroskoopilla johtuen selkäsauna siimoja ja on nimeltään exflagellation. Macrogametocytes kypsyvät macrogametes. Kuitenkin morfologinen tasolla tämä on paljon vähemmän dramaattinen kuin exflagellation näytteille microgametocytes.
Erittäin liikkuva microgametes pyrkii ulos ja sulake kanssa macrogamete. 12-24 tuntia tuloksena tsygootti kehittyy osaksi ookinete. Ookinete on liikkuvia invasiivisia vaihe, joka poikittain sekä peritrophic matriisi ja keskisuolen epiteelin hyttynen. Transversing keskisuolen epiteelin liittyy tunkeutuvat ja purkamisen useita epiteelisolujen ennen syntymässä pohjapinta puolella epiteelin. Invaasio prosessi on samanlainen kuin muut Apicomplexa paitsi että ookinete ei ole rhoptries eikä muodosta parasitophorous ontelon jälkeen tunkeutuu isäntäsolun. (Katso lisätietoja mekanismi isäntäsolun hyökkäystä.)
Sporogony. Saavutettuaan solunulkoisessa tilassa välillä epiteelisolujen ja tyvikalvon, ookinete kehittyy osaksi ookystien. Ookystat tehdään suvuton replikaation, nimeltään sporogony, joka huipentuu tuotannossa useita tuhansia sporotsoiittien. Tämä kestää yleensä 10-28 päivää riippuen lajin ja lämpötilasta. Kun kypsyminen oli tapahtunut ookystien repeämät ja vapauttaa sporotsoiitit jotka ylittävät tyvikalvon osaksi hemocoel (ruumiinonteloon) on hyttynen. (Katso elinkaari kuva.)
Nämä sporotsoiitit ovat liikkuvia ja niillä on kyky tunnistaa spesifisesti sylkirauhaset. Todettuaan sylkirauhasten sporotsoiitit valtaavat ja poikittain sylkirauhasen epiteelisolujen ja asettuvat sen lumenin. Jotkut näistä itiöiden karkotetaan osaksi selkärankaisen isännän kuin hyttynen vie veren aterian, ja siten aloittaa uudelleen tartunnan selkärankaisten isäntä. Vaikka hemocoel ja sylkirauhasen itiöiden ovat morfologisesti samanlaisia, ne ovat toiminnallisesti erillisiä. Sylkirauhasten itiöiden tehokkaasti hyökätä maksasolut, mutta voi uudelleen hyökätä sylkirauhaset, kun taas hemocoel sporotsoiiteista ovat tehottomia hyökkääviä maksasoluja.
Yhteenvetona malaria loinen osoittaa elinkaaren tyypillinen Apicomplexan ominaisuuksia. On olemassa kolme erillistä invasiivisia vaihetta: eläinitiön, Merotsoiittien ja ookinete. Kaikki on tunnusomaista apikaalisella organellit ja voivat tunkeutua tai kulkea isäntäsoluissa. Kahta eri tyyppiä merogony havaitaan. Ensimmäinen, nimeltään exoerythrocytic schizogony, tapahtuu maksassa ja aloitetaan sporotsoiitti-. Tuloksena merotsoiitit sitten hyökätä punasolujen ja tehdään useaan kertaan merogony kutsutaan erytrosyyttiympäristössä schizogony. Osa merotsoiitit tuotettu punasolujen schizogony läpikäy gamogony. Plasmodium gamogony on kuvattu kahdessa vaiheessa: gametocytogenesis esiintyvien verenkiertoon selkärankaisen isännän, ja gametogeneesiin tapahtuu hyttynen suolistossa. Sukusolujen sulake tulla tsygootti, joka ensimmäisenä kehittyy osaksi ookinete ja sitten tulee ookystien jossa sporogony tapahtuu.
(Katsauksen elinkaaren kuluessa hyttynen nähdä LA Baton, LC Ranford-Cartwright (2005) levittäminen siemenet miljoonan murhasta kuollessa muodonmuutoksia malarian hyttynen. Suuntaukset parasitologia 21, 573-580.
Kliiniset ilmentymät
Patologian ja kliiniset oireet liittyvät malaria ovat lähes yksinomaisesti suvuttomien erytrosyyttivaiheen loisia. Tissue skitsontit ja gametocytes aiheuttaa vähän, jos lainkaan, patologia. Plasmodium-infektio aiheuttaa akuutti kuumeinen sairaus, joka on merkittävin sen määräajoin kuume paroxysms esiintyviä joko 48 tai 72 tunnin välein. Vakavuudesta hyökkäys riippuu Plasmodium lajeista sekä muut olosuhteet, kuten immuniteettitilan ja yleinen terveydentila ja ravitsemustilanteeseen infektoituneen yksilön. Malaria on krooninen sairaus, joka on taipumus taudin uusiutumiseen tai uusivat (katso selitys ero) yli kuukausia tai jopa vuosia.
Yleisin tapa saada malaria on kautta luonnollinen siirto hyttysten (ks elinkaari). Malaria voidaan lähettää myös kautta verensiirroissa tai jakamalla ruiskuja. Mekaaninen voimansiirto tarttuneen veren johtaa lyhyemmän itämisaika koska ei tule maksan vaiheessa. Myös lisääntynyt riski kuolemanriskin mekaanisesti välittyvä P. falciparum. Puute maksan vaiheessa infektio on ristiriidassa myös pahenemisvaiheita P. vivax tai P. ovale infektioita. Synnynnäinen siirto on myös dokumentoitu, mutta niiden uskotaan olevan suhteellisen harvinaisia, vaikka raskas infektio istukan.
| Exoerythrocytic schizogony ja prepatent ja itämisaika | ||||
| P. falciparum | P. vivax | P. ovale | P. malariae | |
| Prepatent ajan (päivää) | 6-9 | 8-12 | 10-14 | 15-18 |
| Itämisaika (päivää) | 7-14 | 12-17 | 16-18 | 18-40 |
| Merotsoiittien kypsyminen (päivää) | 5-7 | 6-8 | 9 | 12-16 |
| Merotsoiittien tuotettu | 40,000 | 10,000 | 15,000 | 2,000 |
Oireita malaria yleensä alkaa näkyä 10-15 päivä kuluttua puremasta tartunnan hyttysen. Tyypillinen prepatent ja itämisaika seuraava itiövastaisten rokotus vaihtelevat lajin (taulukko). Prepatent aikana määritellään välinen aika eläinitiön siirrostuksen ja ulkonäkö loisia veressä ja edustaa kesto maksan vaiheessa ja määrä merotsoiittien tuotettu. Inkubaatiojaksot taipumus olla hieman pidempi ja määritellään välinen aika eläinitiön rokotus ja oireiden alkamisesta. Joskus itämisaika voi pidentää useita kuukausia P. vivax, P. ovale ja P. malariae. Kaikki neljä lajia voi esiintyä epäspesifisiä ennakko-oireita muutama päivä ennen ensimmäistä febril hyökkäys. Nämä ennakko-oireita ovat yleensä kuvataan “flunssan kaltaisia” ja kuuluu: päänsärky, lievä kuume, lihaskivut, ruokahaluttomuus, pahoinvointi ja väsymys. Oireet ovat yleensä korreloivan yhä enemmän loisia.
Nämä ennakko-oireita seuraa kuumeinen iskujen tunnetaan myös malariavyöhykkeillä paroxysms. Nämä paroxysms näytteille kausittaisuuksista 48 tuntia P. vivax, P. ovale ja P. falciparum, ja 72 tunnin ajanjaksot P. malariae. Aluksi jaksotus näiden paroxyms voi olla epätasainen, koska poikueet merotsoiittien eri exoerythrocytic skitsonttien synkronoida. Tämä pätee erityisesti P. falciparum, joka ei saa ilmetä erillisiä paroxysms, mutta näytteille jatkuva kuume, päivittäin hyökkäyksiä tai epäsäännöllinen hyökkäysten (esim., 36-48 tuntia jaksotus). Potilaat voivat myös esiintyä splenomegaly, hepatomegalia (lievä keltaisuus), ja anemian aikana, jossa malaria paroxysms esiintyä.
| Malarialoisen kohtaus | ||
| kylmävaihekäsittely | kuuma vaihe | hikoilu vaihe |
|
|
|
|
|
|
|
|
|
|
|
|
Malarialoisen paroxysm (katso taulukko) kestää yleensä 4-8 tuntia ja alkaa äkillisesti alkanut vilunväreet, jossa potilas kokee voimakas tunne kylmää huolimatta korkeassa lämpötilassa. Tämä on usein kutsutaan kylmä vaiheessa ja on ominaista voimakas vilunväristykset. Välittömästi tämä kylmä vaihe on kuuma vaihe. Potilas kokee voimakas lämpö liittyy voimakas päänsärky. Väsymys, huimaus, ruokahaluttomuus, lihaskivut ja pahoinvointi usein liittyä kuuma vaiheessa. Seuraavaksi ajan runsas hikoilu tullaan käymään ja kuume alkaa pienentyä. Potilas on käytetty loppuun ja heikko ja yleensä nukahtaa. Herättyään potilas yleensä tuntee hyvin, muut kuin väsynyt, ja ei osoita oireita ennen puhkeamista seuraavan kohtaus.
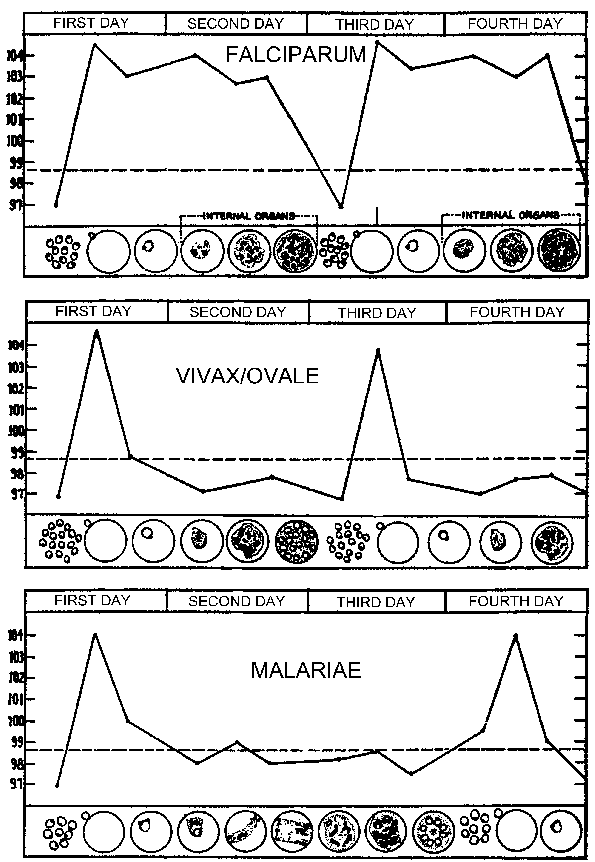
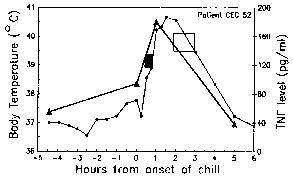
Jaksotus Näiden paroxysms johtuu synkroninen kehitystä Malarialoisen sisällä ihmisen isäntä. Toisin sanoen, kaikki loiset sisällä isäntä ovat suunnilleen samassa vaiheessa (eli rengas, trofotsoiittivaihe, skitsontti-), koska ne edetä läpi schizogony. Malarialoisen paroxysm vastaa repeäminen tartunnan punasolujen ja vapauttaa merotsoiittien (Kuva yllä). 72 tunnin jaksollisuutta P. malariae johtuu sen hitaamman kasvun ja kypsymisen aikana veri-vaiheen schizogony. Tutkimuksissa P. vivax ovat osoittaneet korrelaation kuumetta ja seerumin TNF-α (tuumorinekroositekijä-alfa) tasot (kuvio oikealla). Oletettavasti antigeenejä tai myrkkyjä vapautuu, kun tartunnan punasolujen repeämät ja johtaa tuotannon TNF-α ja kuumeinen hyökkäyksiä.
Vakavuudesta paroxysms ja oireiden kestosta vaihtelee lajin (katso taulukko alla). Yleensä sairauden vakavuudesta korreloi keskimääräinen ja suurin parasitemia näytteillä eri lajeja. P. falciparum kykenee tuottamaan vakava ja tappava infektio, kun taas muut lajit ovat harvoin kuolevaisia. Saaneiden potilaiden P. vivax, erityisesti ensimmäisen kerran, voi olla hyvin sairas. Kuitenkin P. vivax harvoin aiheuttaa komplikaatioita tai johtaa kuolemaan. On tilaisuudessa vaikea malaria johon sisältyy useita elimissä on myös todettu P. vivax infektiot (ks Kochar et al, EID 11 (1), tammikuu 2005). Pahenemisvaiheita aktivoinnin P. vivax hypnotsoiitteihin voi esiintyä useita vuosia. P. ovale on kaikkein hyvänlaatuinen että paroxysms yleensä lieviä ja lyhytkestoisia ja pahenemisvaiheita harvoin esiintyy yli vuoden kuluttua alkuperäisen tartunnan. P. malariae yleensä tuottaa lievän taudin, mutta alkuperäisen paroxysms voi olla keskivaikea tai vaikea. Se on kaikkein krooninen, vaikka, ja recrudescences on dokumentoitu useita vuosikymmeniä sen jälkeen, kun alkuperäinen infektio. Tämä kroonisuuden on joskus liittynyt munuaisten komplikaatioita, jotka johtuvat todennäköisesti laskeuman antigeeniyhdistelmät in keräsissä munuaisissa. Malarialoisen paroxysms tulee lievempiä ja epäsäännöllinen jaksotus kuin isäntä kehittyy immuniteetti. Tämä immuniteetti, ei kuitenkaan ole steriloivan immuniteetin että infektio jatkuu kauemmin kuin oireet ja yksilöt voivat esiintyä pahenemisvaiheita tai recrudescences tai tulla uudelleen tartunnan. Hoitamattomana kaikenlaisen malarian yleensä krooninen.
| Sairauden vakavuuden ja kesto | ||||
| vivax | ovale | malariae | falciparum | |
| Alustava paraoxysm vakavuus | kohtalainen tai vaikea | lievä | kohtalainen tai vaikea | vaikea |
| Keskimääräiset parasitemia (mm3) | 20,000 | 9,000 | 6,000 | 50,000-500,000 |
| Suurin parasitemia (mm3) | 50,000 | 30,000 | 20,000 | 2,500,000 |
| Oireiden kesto (käsittelemätön) | 3-8 + viikkoa | 2-3 viikkoa | 3-24 viikkoa | 2-3 viikkoa |
| Suurin infektio kesto (käsittelemätön) | 5-8 vuotta | 12-20 kuukautta | 20-50 + vuotta | 6-17 kuukautta |
| Anemia | ++ | + | ++ | ++++ |
| Komplikaatiot | munuais- | aivojen | ||
| Muokattu Markell ja Voge Lääketieteellisen Parasitologia | ||||
Toisin kuin kolme muuta lajia, P. falciparum voi tuottaa vakava sairaus, jossa kuolevainen seurauksia. Tämä lisääntynyt sairastuvuus ja kuolleisuus johtuu osittain korkea parasitemiat liittyy P. falciparum infektioita. Nämä mahdollisesti suuri parasitemiat johtuvat osittain suuren määrän merotsoiittien tuotettujen ja kyky P. falciparum hyökätä kaikkien punasolujen. Sen sijaan, P. vivax ja P. ovale mieluummin retikulosyytteihin (eli punasolujen), kun taas P. malariae parempana senescent punasolujen (katso eläinten välillä). Parasitemia voi myös nopeasti kasvavat, koska cytoadherence ja varastoimalla P. falciparum. Tämä sitomista kudoksissa minimoi tartunnan saaneen punasolujen perna ja mahdollistaa tehokkaamman punasolujen invaasio .. Korkeat parasitemialla ja sitomisen seurauksena muissa komplikaatioita falciparum malaria, merkittävimpänä anemia ja aivojen malariaa (käsitellään seuraavassa jaksossa ). Anemia johtuu osittain tuhoaminen punasolujen aikana veren vaiheen schizogony. Lisäksi ei-tartunnan erytrosyytit tuhoutuvat korkeampi infektion aikana, ja on vähentynyt tuotanto punasolujen.
| Lisääntynyt ja kuolleisuuden falciparum malaria |
|
|
|
|
|
Patogeneesi ja vaikea malarian
Patologia liittyy kaikkien malaria laji on sukua repeämä tartunnan punasolujen ja vapauttaa loinen materiaalin ja aineenvaihduntatuotteiden, hemozoin (eli malaria pigmentti) ja solujen roskia. Lisäksi paroxysms edellä, laskeuman hemozoin on jo pitkään ollut tunnettu luonteenomainen piirre malaria. On lisääntynyt aktiivisuus retikuloendoteliaalijärjestelmän, erityisesti maksassa ja pernassa ja siten niiden laajentumiseen, mistä on osoituksena makrofagien kanssa nautitaan tartunnan ja normaalin punasolujen ja hemozoin. Paitsi P. falciparum, patologian liittyvät malarian yleensä hyvänlaatuinen. Useita vakavia komplikaatioita voi liittyä falciparum malariaa aivomalaria ollessa voimakkaimmillaan ja usein kuolinsyy.
Aivomalaria on ominaista tajunnan (Box). Esittämisvälineillä oireet ovat vakavia päänsärky seuraa uneliaisuus, sekavuus, ja lopulta kooma. Kouristukset ovat myös usein liittyy aivojen malaria. Nämä neurologisten oireiden uskotaan johtuvan sitomisen tartunta erytrosyyttien aivojen mikrovaskulaarisessa. Takavarikko viittaa cytoadherence on trophozoite- ja skitsontti–tartunnan punasolujen endoteelisoluihin syvän verisuoniston elintärkeissä elimissä, erityisesti aivo-, keuhko-, gut, sydän ja istukka. Tämä sitomista tarjoaa useita etuja loinen. Merkittävä etu on välttää perna ja eliminaatioon tartunnan punasolujen. Lisäksi alhainen happipitoisuus jännitteitä syvälle kudoksiin voi tarjota paremman metabolisen ympäristössä.
Cytoadherence näyttää välittyvän elektronitiheisiin ulkonemia pinnalle tartunta punasolujen. Nämä “nupit” ilmaistaan aikana trofotsoiittivaihe ja skitsontti- vaiheet ja muodostetaan seurauksena loinen proteiineja viedään punasolujen kalvo. Niistä ihmisen Plasmodium lajeja, nupit rajoittuvat P. falciparum ja siten ehdottaa, että nupit osansa cytoadherence. Lisäksi on myös hyvä korrelaatio eläimen Plasmodium lajien, jotka ilmentävät nupit ja näyttelytila sitomista. Elektronimikroskoopilla osoittaa myös, että nupit ovat väliset kosketuskohdat tartunnan punasolujen ja endoteelisolujen.
| Aivojen malaria |
|
Molekyylimekanismeihin cytoadherence liittyy reseptori-ligandi-vuorovaikutuksia. Toisin sanoen, proteiinit ilmentyvät pinnalla tartunnan punasolujen (ligandi) sitoutuu ilmennettyjen proteiinien pinnalla endoteelisolujen (reseptori). PfEMP-1 (punasolujen kalvo proteiini) on loinen proteiini, joka on ollut mukana, kun cytoadherence ligandia (Box). Sen constrast tavallisesti erittäin konservoitunut luonne reseptori-ligandi-vuorovaikutusten, PfEMP-1 on jäsen, vaihtelevat suuresti (= var) geeniperheen kanssa 40-50 eri geeniä. Useita isäntä proteiineja, jotka mahdollisesti toimivat reseptorit on tunnistettu (katso alla)
| PfEMP-1 |
|
Monet näistä isännän proteiinit toimivat solu-solu-vuorovaikutuksiin, ja ovat mukana soluadheesiota. Useat tutkimukset ovat osoittaneet, että ilmaisun eri PfEMP-1-geenien korreloi eri reseptoria sitovaa fenotyyppejä. Tämä antigeeninen vaihtelu liittyy pinta altistuu PfEMP-1 mahdollistaa loinen kiertää immuunijärjestelmää. Kuitenkin cytoadherence toiminto säilyy kautta kyky tunnistaa useita reseptoreihin (kuva). Tämä antigeeninen vaihtelu voi myös selittää eri tautien tuloksia. Esimerkiksi, solujen välinen adheesiomolekyyli-1 (ICAM-1) on yleensä liitetty serebraalinen.
| Mahdolliset reseptorit |
|

Havaintoihin patologian aivomalarian ehdotti suhde suuri määrä tartunnan punasolujen hiussuonistossa ja kehitystä oireyhtymä. Aluksi oletettiin, että cytoadherence johtaisi mekaaninen tukos (eli aivoiskemian) ja sen jälkeen hypoksia. Lisäksi loinen voi myös aiheuttaa paikallisia vaikutuksia aineenvaihduntaan, kuten hypoglykemia ja / tai maitohappoasidoosi. Hypoksiaa ja metabolisia vaikutuksia sitten aiheuttaa kooman ja myöhemmin kuolemaan. On kuitenkin olemassa joitakin ongelmia sitomista hypoteesi:
- koomaan liittyvä aivojen malaria korjaantuu nopeasti käsiteltäessä,
- suuri osa eloonjääneitä ole pysyvät, neurologisia komplikaatioita,
- puute iskeeminen vaurio (sulkee pois hypoksia pääasiallisina mekanismi),
- sitomista esiintyy myös ei-aivojen malaria.
| Neurologiset jälkitauteja joukossa eloonjääneitä aivomalarian: |
| 23,3% kotiutettaessa 8,6% yhden kuukauden 4,4% kuuden kuukaudenvan Hansbroek (1997) J. Ped. 131: 125 |
Näiden ongelmien vuoksi toiset ovat ehdottaneet, että kooma välittyy lyhytikäisiä molekyylejä, jotka vaikuttavat aivojen toimintaan. Mahdollisia isäntä välittäjäaineita ovat sytokiinit, kuten TNF-a tai typpioksidia. Tässä sytokiini Teoriassa malaria antigeenejä kiihdyttäisi TNF-a, joka voisi aiheuttaa typpioksidin tai muita patologisia vaikutuksia. Typpioksidi tiedetään vaikuttavan hermosolujen toimintaa ja se voisi myös johtaa kallonsisäisen paineen kautta verisuonia laajentava aktiivisuus. On epätodennäköistä, vaikka, että systeeminen sytokiinien aiheuttaisi kooman ja tarvitsee myös olettaa, että vapautuminen näistä välittäjäaineiden aivoissa johtaisi paikallisesti korkeita. Lisäksi on vielä vähän lymfosyyttien tunkeutumisen tai tulehdus liittyy tukossa kapillaareja.
Takavarikoimista hypoteesi ja sytokiinien teoriaa patofysiologia aivojen malaria eivät sulje toisiaan pois, ja molemmat ilmiö todennäköisesti mukana. Esimerkiksi loinen ekso-antigeenejä, jotka vapautuvat punasolujen repeämä, tiedetään stimuloivan makrofageja erittämään TNF-a. TNF-a on tunnettu upregulate adheesiomolekyylien, kuten ICAM-1 pinnalla aivojen endoteelisoluissa. Tämä johtaisi lisätä sitoutumisen tartunnan punasolujen ja vahvistavat vaikutukset, ovatko ne johtuvat verisuonten tukos, liukoinen välittäjien vaikutuksia aineenvaihduntaan, tai niiden yhdistelmä (kuva).
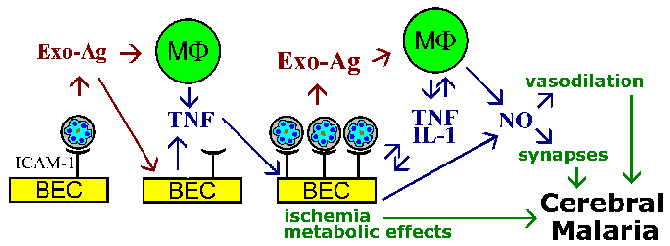
Yhteenvetona:
- P. falciparum aiheuttaa vakavan ja kuolemaan johtava sairaus
- Tämä lisääntynyt patogeenisyys verrattuna muihin ihmisen malarian liittyy P. falciparum n:
- korkea lisääntymiskykyyn
- cytoadherence ja sitomista
- sitomista myötävaikuttaa korkeampi lisääntymiskyky kautta perna välttäminen
- cytoadherence endoteelisoluihin voisi myös paikallisia patologisia vaikutuksia ja erityisesti on todennäköisesti mukana aivojen malaria
- patofysiologiaan aivojen malaria ei täysin tunneta, mutta todennäköisesti liittyy useita tekijöitä, ja monimutkaiset vuorovaikutukset isäntä ja loinenKatsauksia vaikea malaria ja synnyssä:
- IA Clark, WB Cowden (2003) patofysiologiassa falciparum malaria. Pharmacology & Therapeutics 99, 221-260.
- R Idro, NE Jenkins, CRJC Newton (2005) Patogeneesi, kliiniset piirteet, ja neurologiset tuloksista aivojen malaria. The Lancet Neurology 4, 827-840.
- CL Mackintosh, JG Beeson, K Marsh (2004) Kliiniset piirteet ja patogeneesi vakava malaria. Trends in Parasitologia 20, 597-603.
- Trampuz, M Jereb, minä Muzlovic, RM Prabhu (2003) Clinical tarkastelu: Vaikea malaria. Critical Care 7, 315-323.
Epidemiologia
Mene jakso:
- immuniteetti
- ihmisgenetiikassa
- malarian yhdysvalloissa
- ohjaus
Malaria on ensisijaisesti sairaus tropiikissa ja subtropics ja on laajalle levinnyt kuumassa kosteassa alueilla Afrikassa, Aasiassa sekä Etelä- ja Keski-Amerikassa. Tauti oli yleinen myös monissa lauhkean alueilla kuten Yhdysvalloissa, Euroopassa ja Pohjois-Euraasiassa ja Aasiassa, mutta on hävitetty. Monilla aloilla, jotka aiemmin oli malaria hallinnassa kokevat elpyminen (katso artikkeli The Atlantic). Neljä Ihmisen malaria lajin näytteille päällekkäisiä maantieteellinen jakautuminen (taulukko). P. vivax ja P. falciparum ovat useimmin lajien P. vivax ovat laajimmalle levinnyt maantieteellisesti. Mixed-infektiot ovat yleisiä endeemisillä alueilla. Molekyylimenetelmät viittaavat siihen, että P. malariae ja P. ovale voisi olla nykyistä laajempaa ja yleisempää, että aiemmin on ajateltu (katso Mueller et ai, Tr. Parasitol. 23: 278, 2007).
| Maantieteellinen jakaumat | |||
| vivax | falciparum | malariae | ovale |
|
|
|
|
Epidemiologia malarian voidaan tarkastella siinä mielessä, että vakaa (tai endeemisiä) tai epästabiili (tai epidemia). Stable malaria viittaa tilanteeseen, jossa on mitattavissa esiintyvyys luonnon lähetyksen useiden vuosien ajan. Tähän kuuluisivat myös alueita, jotka kokevat vuodenaikojen lähetys. Eri alueet voivat kokea eri ilmaantuvuus ja tämä on usein merkitty: hypoendemic, mesoendemic, hyperendemic, ja holoendemic. Henkilöt, jotka asuvat erittäin endeemisillä alueilla yleensä omaavat korkean immuniteetin ja sietää infektiota hyvin.
Epävakaa tai epidemia, malaria viittaa lisääntymiseen malaria harvaan endemisöityminen tai epidemioista alueille aikaisemmin ilman malaria tai muun ei-immuuni henkilöille. Epidemioilla voidaan yleensä johtuvan muutoksiin ihmisen käyttäytymiseen tai ympäristövaikutuksia. Esimerkiksi ihmisen muuttoliike ja uudelleensijoittamista voi joko ottaa käyttöön malarian tietylle alueelle tai paljastaa aiemmin ei-immuuni väestön endeemisiin lähetyksen. Muutokset ekologian aiheuttamien luonnonkatastrofien tai julkinen rakentaminen esimerkiksi teiden rakentamiseen voivat myös vaikuttaa malaria lähetyksen ja aiheuttaa epidemioita.
“Kaikkea tietoa malaria on niin muovataan paikalliset olosuhteet, että siitä tulee tuhat epidemiologinen arvoituksia.”
Hackett (1937)
Yllä lainaus korostaa monimutkaisuus malarian ja monien puolia taudin näyttelyitä. Eri yhteisöjen kokevat erilaisen malaria ja näin ollen erilainen ohjaus ja hoitostrategioita saattaa olla tarpeen. Monimutkaisia vuorovaikutukset isäntä, loinen, ja vektori ovat merkittäviä tekijöitä tässä epidemiologisissa monimutkaisuus.
| Malaria epidemiologia |
vakaa tai endeeminen malaria
epävakaa tai epidemia malaria
|
Esimerkiksi kuten kaikkien vektori tarttuvien sairauksien, loisen on kyettävä luomaan krooninen infektio sisällä isäntä maksimoida mahdollisuuksia lähetystä. Tämä pätee erityisesti, kun kyseessä on kausiluonteinen siirto- ja harvaan endemisöityminen. Ja yleensä malaria infektiot ovat ominaista ensimmäisen akuutin vaiheen jälkeen on enää suhteellisen oireeton kroonisessa vaiheessa. Tämä johtuu osittain siitä, että kyky loisen välttää täydellinen poistuminen immuunijärjestelmän. Esimerkiksi P. falciparum esittelee antigeenistä vaihtelua, joka sallii sen pysyä askeleen edellä immuunijärjestelmää. Lisäksi P. vivax ja P. ovale näytteille hypnozoite vaiheessa ja pystyvät pahenemisvaiheita. Tämä mahdollistaa sen, että loisen säilyttää tartunnan ihmisen sisällä isäntä senkin jälkeen, kun veri vaiheessa infektio on poistettu. Suhteellinen pitkä väli pahenemisvaiheita joissakin P. vivax isolaattien luultavasti selittää sen kykyä ylläpitää lähetyksen syklien joissakin lauhkeilla.
Useat molekyyliepidemiologiset tutkimukset ovat osoittaneet, että P. falciparum voi myös tuottaa pitkäaikaista krooniset infektiot (katso Roper ym alla).
Köyden et al (1996) AJTMH 54: 325
|
Treffi % esiintyvyys Testattu (Kokeena / PCR)* syyskuu 93 13% (2/8) Jan 94 19% (4/11) } 33% raportoitu oireita huhtikuu 94 24% (8/11) kesäkuu 94 19% (0/14) } Ei oireenmukaista tapauksia *Yksilöiden lukumäärä positiivisen testituloksen veren kokeena ja PCR. PCR määritys havaitsee ~ 2,5 loiset / ml (4-10X herkempi kuin paksu tahroja). |
Suhteen isäntä, ihmiset ovat ainoa merkittävä varastona loinen ja jatkuva siirto riippuu säilyttää altaan infektoituneiden yksilöiden ja kosketus ihmisten ja anopheline hyttysiä. Useat tekijät vaikuttavat alttiuteen ihmisten infektioille. Ilmeisesti immuniteetti yksilön ja niiden aiempaa kokemusta malaria vaikuttavat infektion kulkua. Raskaana olevat naiset, erityisesti ensimmäisten raskauden, ovat alttiimpia falciparum malarian kuten osoittaa muita yleisemmin infektio ja korkeamman parasitemiat. Lisäksi tietyt geneettiset sairaudet ja polymorfismit on liitetty lasku infektio tai sairaus (ks Synnynnäinen vastus).
Potentiaali hyttysen toimimaan vektori riippuu kyvystä tukea sporogony, hyttynen runsaus, ja yhteyttä ihmisiin, jotka kaikki vaikuttavat ilmastolliset ja ekologiset tekijät (taulukko). Kyky tukea sporogony on suurelta osin riippuvainen lajeja, etteivät kaikki lajit Anopheles ovat alttiita Plasmodium tartunnan. Lämpötilan ja hyttysten pitkäikäisyys ovat muita keskeisiä tekijöitä, jotka vaikuttavat loisen vuorovaikutusta vektorin. Kehittäminen P. falciparum edellyttää vähintään lämpötila 20oC, kun taas alin lämpötila muiden lajien on 16oC. Lämpötila vaikuttaa myös kehityksen aikaa, että kesto sporogony on huomattavasti lyhyempi korkeammissa lämpötiloissa. Lyhyempi kesto sporogony lisää mahdollisuuksia, että hyttynen tulee tartunta sen elinikä.
| Vaikuttavat tekijät vectorial Kapasiteetti | ||
Sporogony
|
Hyttynen tiheys
|
Ihmisen yhteydenotto
|
Hyttynen tiheys ja ruokatottumuksiin vaikuttavat myös välittämistä malaria. Hyttynen tiheys vaikuttaa lämpötila, korkeus, sademäärä ja saatavuus pesimäpaikkoja, kun taas ihmisen-hyttynen kosketus vaikuttaa hyttynen käyttäytymistä. Esimerkiksi missä määrin tietty hyttysen laji on anthropophilic vaikuttaa todennäköisyys hyttynen tartunnan ja sitten välittää tartunnan toisen ihmisen. Nämä anthropophilic suuntaukset ovat välttämättä ehdoton, että monet zoophilic hyttysiä siirtyy ihmiseen jos tiheydet korkeakouluja tai mieluummin eläimen lähde vähentynyt. Edullinen ruokinta-aika ja onko hyttynen syötteet pääasiassa sisätiloissa tai ulkona vaikuttavat lähetyksen dynamiikkaa. Esimerkiksi ulkona ruokinta hyttysiä ovat todennäköisesti löytää ihmisen veren aterian alkuillasta kuin ruokinta myöhään yöllä, kun useimmat ihmiset ovat sisällä. Käyttäytyminen hyttynen on myös tarkasteltava valvontatoimiin.
“Paradoksaalisesti riskit vakava sairaus lapsuudessa oli alhaisin väestön korkein siirto intensiteettiä, ja korkein taudin riskit havaittiin keskuudessa väestö altistuu matalan kohtalaiseen intensiteettejä lähetyksen.”
Snow et al (1997) Lancet 349: 1650
Immuniteetti
Henkilöt, jotka asuvat endeemisillä alueilla do kehittää immuniteetin malariaa. Lähes aina henkilö voi ilmetä oireita aikana alkuperäisen vastuiden malaria. Liittyviä oireita myöhemmin vastuita malaria ovat yleensä lievempiä, vaikka. Immuniteetin malaria on kehittynyt hitaasti ja vaatii päällekkäisvalotuksia. Vahvasti endeemisillä alueilla vain pienet lapset ovat suuri riski saada vaikeita falciparum malaria taas vanhemmat lapset ja aikuiset olennaisesti suojassa vakava sairaus ja kuolema. Kuitenkin tämä koskemattomuus ei ole sterilointia immuniteetin henkilöt voivat silti saada tartunnan. Lisäksi koskemattomuutta on lyhytikäisiä ja ilman toistuva altistuminen tason immuniteetin vähenee. Esimerkiksi aiemmin puoliksi immuuni aikuiset kehittävät usein vaikea malaria palattuaan endeemiselle alueelle oltuaan ei-endeeminen alue 1-2 vuoden ajan. Tämä tila osittaisen immuniteetin, joka parasitemia on laskettu, mutta ei eliminoida, ja parasitemia on paremmin siedetty (kuva) on joskus kutsutaan esi-immunisointi- vaiheelle. Esi-immunisointi- vaiheelle viittaa immuniteetti, joka on riippuvainen taudinaiheuttaja on läsnä.
Immuunivaste voitaisiin suunnata joko ennalta punasolujen tai punasolujen vaiheissa loisen elinkaaren. Kuitenkin erytrosyyttivaiheen elinkaaren on todennäköisesti tärkein kannalta clearing loisen sekä vähentämään sairauden. Koska ei ole HLA-molekyylien pinnalla loisen tai punasolujen se on yleensä oletetaan, että vasta-aine on keskeinen rooli veren vaiheessa immuniteetin. Mahdollisia tiedoksiannon mekanismeja vasta-kuuluvat: esto punasolujen hyökkäystä merotsoiiteista, aineista riippuvainen soluvälitteinen tappaminen välittämän sytofiiliset vasta-aineita tai lisääntyneeseen puhdistumaan tartunnan punasolujen vuoksi vasta-aineiden sitoutuminen parasiittiantigeenejä paljaana punasolujen pinnalla. Kaikki nämä johtaa alempaan parasitemiaan. Suhteellinen merkitys näiden eri mekanismien ei ole selvä ja luultavasti immuniteetin todennäköisesti edellyttää sukupolven vasta-aineita lukuisia tavoitteita. Tämä yhdessä antigeenien vaihtelun ja polymorfismit monissa Plasmodium antigeenejä, voisi selittää hitaan immuniteetin kehittymistä.
Havainto, että oireettomien yksilöiden voi esiintyä korkeita parasitemialla on johtanut käsitteen “anti-tauti immuniteetti”. Tämä olisi lisäksi “anti-loinen” immuniteetin edellä mikä vähentää parasitemiat. Vaikea malaria ja kuolemaan korreloivat TNF-α ja muiden proinflammatoristen sytokiinien. Kuten varten paraxoysms ja aivojen malaria, antigeenejä tai myrkkyjä vapautuu tartunnan punasolujen voisi stimuloivat proinflammatoristen sytokiinien. Vasta-aineita nämä ekso-antigeenejä voisi neutraloida niiden myrkylliset vaikutukset ja johtaa siten anti-tauti immuniteetti.
arvostelu sakoista Malaria:
J Langhorne, FM Ndungu, AM Sponaas, K Marsh (2008) Immunity malariaan: enemmän kysymyksiä kuin vastauksia. Nature Immunology 9, 725-732.
Koska vaikeuksia valvoa malariaa muilla keinoin on paljon kiinnostusta kehittää rokotetta malariaa. Tällä hetkellä ei ole saatavilla rokotetta, mutta on huomattavaa tutkimustyötä suunnattu tunnistamaan rokotteita ja testaamalla mahdollisia rokotteiden turvallisuuden ja tehokkuuden. Monimutkainen elinkaari ja biologiaan loisen tarjoavat useita mahdollisia kohteita (taulukko 15.9). Esimerkiksi rokotusten sporotsoiitti- tai exoerythrocytic vaiheessa voisi estää tulehduksia. Kuitenkin aiheuttama immuniteetti olisi täysin tehokasta, koska paeta yhden eläinitiön johtaisi veren vaiheessa infektio ja sairaus. Rokotteet kohdistettu merotsoiitit tai tartunnan punasolujen alentaisi parasite- häiritsemällä Merotsoiittien invaasio tai lisäämällä poistaminen tartunnan punasolujen. Tällainen rokote voi mahdollisesti lievittää paljon synnyssä liittyy malariaan, vaikka se ei täydellinen tehokasta. Lisäksi, infektio voi palvella tehostaa immuunivastetta. Se voi olla mahdollista rokottaa tautia vastaan immunisoimalla vastaan mahdollisesti myrkyllisiä antigeenejä. Vasta-aineet neutraloivat antigeenejä että stimuloivat proinflammatoristen immuunivaste voi vähentää joitakin synnyssä liittyy malariaan. Seksuaalinen vaiheissa loisen kuten gametocytes ja sukusolut voitaisiin myös kohdentaa. Vastaan suunnattuja vasta sukusolujen antigeenejä voi estää infektio hyttysten ja sporogony. Sellainen rokote olisi pyyteetöntä, että se ei suojaa yksilön tautia, mutta suojaavat muita yhteisön alentamalla lähetyksen.
| Mahdolliset rokote strategiat | ||
| Kohde
itiövastaisten merotsoiittien tartunnan RBC exoantigens seksuaalinen vaiheissa |
Suojaus
anti-infektio anti-loinen anti-loinen anti-tauti anti-siirto |
Mekanismi
ehkäisemiseksi ja poistamiseksi maksan vaiheessa vähentää tehokkuutta Merotsoiittien invaasio lisätä puhdistumaa tartunnan punasolujen alempi inflammatoristen sytokiinien tuotantoon poistaa sukusoluja tai tartuntavaaran hyttysiä |
Ihmisgenetiikassa ja synnynnäinen vastus
Synnynnäinen vastus
- Duffy-negatiivinen
- ovalcytosis
- sirppisoluanemia
- talassemia
- G6PD puutos
Tietyt perinnöllisiä sairauksia ja polymorfismit on liitetty lasku infektio tai sairaus (Box). Esimerkiksi yksilöt joista puuttuu Duffy veri-ryhmä antigeeni reagoivat huonosti P. vivax. Suuri osa väestön Länsi-Afrikassa ovat Duffy negatiivisia, mikä osuus alhaisten P. vivax Länsi-Afrikassa. Tämä luontainen vastustuskyky johti tunnistamiseen Duffy antigeenin punasolujen reseptorin Merotsoiittien hyökkäystä. (Katso reseptori-ligandi-vuorovaikutusten aikana Merotsoiittien hyökkäystä.)
Useat perinnöllinen punasolujen häiriöt löytyy pääasiassa malaria-alueilla ja taajuuksilla paljon odotettua suurempi. Tämä on johtanut keinotteluun, että nämä sairaudet antavat jonkin verran suojaa malariaa vastaan. Esimerkiksi Kaakkois-Aasian ovalcytosis johtuu mutaation punasolujen kalvon proteiinin band 3. Tämä mutaatio aiheuttaa punasolujen kalvo tulee jäykempi ja refraktorinen Merotsoiittien hyökkäystä. Mekanismi (t), jonka muut sairaudet saattavat antaa suojan malaria ei tunneta. Useimmissa tapauksissa oletetaan tai arveltu, että yhdistelmä vika ja infektio johtaa ennenaikaiseen hajoamiseen tai puhdistumaan tartunnan punasolujen. Esimerkiksi glukoosi-6-fosfaattidehydrogenaasin (G6PD) puutos punasolujen olisi heikentynyt kyky käsitellä oksidatiivista stressiä (katso huumeiden toiminta). Ylimääräiset oksidanttijäämät seurauksena loinen aineenvaihduntaa ja ruoansulatusta hemoglobiinin (ks biokemia Huomautukset) voi hukuttaa tartunnan punasolujen ja johtaa sen tuhoamista ennen loinen pystyy viimeistelemään schizogony. Sirppisoluanemia ja talassemia myös spekuloitu, jotta tartunnan punasolujen alttiimpia oksidatiivista stressiä.
Katsauksia punasolujen polymorfismien ja malaria:
G Min-Oo, P Gros (2005) Erytrocyte muunnelmat ja luonteesta malarian suojaava vaikutus. Cellular Microbiology 7, 753-763.
TN Williams (2006) Human punasolujen polymorfismien ja malaria. Current Opinion in Microbiology 9, 388-394.
TN Williams (2006) Punasolujen vikoja ja malaria. Molecular and Biochemical parasitologia 149, 121-127.
Malaria Yhdysvalloissa
Malaria oli aiemmin yleisempää lauhkeilla alueilla kuten Pohjois-Amerikassa ja Euroopassa. Uskotaan, että malaria esiteltiin Amerikassa Euroopan siirtolaiset (P. vivax ja P. malariae) ja Afrikkalainen orjia (P. falciparum) aikana 16. ja 17-luvuilla. Malaria tuli endeeminen monissa osissa Yhdysvaltoja lukuun aavikoita ja vuoristoalueilla ja ilmaantuvuus todennäköisesti korkeimmillaan noin 1875. Populaatio siirtyminen maaseudulta kaupunkeihin, kuivatus soiden luoda viljelysmaata, parannettu asuntojen ja ravitsemuksen, paremmat yhteiskunnalliset olosuhteet ja standardien elävä, parempi saatavuus lääkäripalvelut, ja saatavuus kiniini hoitoon kaikkien laskuun vaikutti yleisyydessä malarian jo ennen käyttöönottoa erityistarkastustoimenpiteitä (Box). Jotkut valvontatoimet, kuten tapauksessa havaitseminen ja hoito, larviciding ja talo ruiskutus, otettiin käyttöön vuonna 1940 ja johti hävittämiseksi malarian Yhdysvalloissa. 1950-luvulta lähtien lähes kaikki malariatapausten Yhdysvalloissa on tuotu. Tärkeimmistä syistä tähän hävittämiseksi näyttävät olevan väestön siirtyminen maaseudulta kaupunkeihin ja kasvu elintason, mikä paransi kotelossa, paremman ravitsemuksen, sekä helpottaa pääsyä sairaanhoidossa.
| Johtavia tekijöitä vähentynyt malaria lähetyksen Yhdysvalloissa |
|
Valtaosa malariatapausten diagnosoitiin Yhdysvalloissa ovat saaneet henkilöt matkoilla maihin, joissa malaria. Kuitenkin 1990-luvulla oli useita epidemioita koskee alkuperäisten malarian lähetyksen Yhdysvalloissa (Zucker, 1996). Epidemioilla liittyi tiheään asutuilla alueilla ja paljon maahanmuuttajia. Yli 80%: ssa tapauksista oli P. vivax. Lisäksi epidemioiden liittyivät epätavallisen kuuma ja kostea sää, mikä voi lisätä anopheline selviytymisen ja vähentää kesto sporogonic kierron, mikä mahdollistaa kehittämisen infektoiva itiöiden. (Katso myös äskettäin raportti seitsemän tapausta paikallisesti hankitun P. vivax malariaa, joka tapahtui Floridassa heinä-elokuussa 2003 MMWR 52: 908.)
Ehkäisyn ja valvonnan
Strategiat ehkäisemiseksi ja hallitsemiseksi malarian mukana kolme erilaista lähestymistapaa (katso laatikko). Ehkäisy malarian yksilöiden liittyy yleensä vähentämään ihmisen hyttysen kontakti avulla bednets, karkotteet, jne kemoprofylaksia (katso alla) voidaan käyttää myös erityisesti matkailijoille. Kuitenkin kemoprofylaksia vain tukahduttaa parasitemialla ja ei estä infektiota.
| vähentää ihmisen hyttynen yhteyshenkilö kyllästetyt bednets karkotteet, suojavaatteet näytöt, house ruiskuttamallavähentää vektori tiheys ympäristön muutos toukkamyrkyt / hyönteismyrkyt biologinen torjuntavähentää loinen säiliö tapauksessa toteaminen ja hoito estolääkityksen |
Valvontatoiminta Kylätason voidaan käyttää lähestymistapoja, jotka suoraan vähentävät ihmisen hyttysen yhteystiedot sekä lähestymistapoja, jotka vähentävät kokonaismäärää hyttysiä alueella. Näitä lähestymistapoja ovat väheneminen hyttynen pesimäpaikkoja (esim ympäristön muutos), kohdistaa toukka vaiheissa kemiallisia tai biologisia aineita, ja massiivinen hyönteismyrkky ruiskutus aikuiselle hyttysiä. Biologinen torjunta menetelmiä ovat istutetaan kalaa joka syö hyttysen toukkia tai bakteerien (esim Bacillus thuringiensis), joka erittää toukkien myrkkyjä. Asia havaitseminen ja hoito on toinen mahdollinen ohjaustapa. Tunnistaminen ja hoitoon tartunnan saaneiden, varsinkin oireeton yksilöitä, tulee pienentää loisen säiliön sisällä ihmisiin ja voi alentaa siirtonopeuksia. Tämä voi kuitenkin olla suhteellisen kallista lähestymistapaa.
Nämä lähestymistavat eivät ole toisiaan poissulkevia ja niitä voidaan yhdistellä. Monet onnistunut ohjaus ohjelmiin sisältyy sekä toimenpiteitä, joilla valvotaan hyttysiä ja hoitoon tartunnan yksilöiden. Ei ole tavanomaista malarian torjunnassa, joka on osoittautunut yleisesti tehokkaaksi. Epidemiologisissa, sosioekonomiset, kulttuuriset ja infrastruktuurin tekijät tietyn alueen määrittelee sopivimman malarian torjunnassa. Joitakin tekijöitä, jotka on otettava huomioon muun muassa:
- infrastruktuuri nykyisen terveydenhoitopalvelujen ja muita resursseja
- intensiteetti ja jaksotus (esim kausiluonteisuus) lähetyksen
- sääskilajien (ekologiset vaatimukset, käyttäytymispiirteet, hyönteisten herkkyys, jne)
- loislajeja ja lääkeherkkyyksiä
- kulttuuriset ja sosiaaliset ominaispiirteet väestön
- läsnäolo sosiaalisen ja ekologisen muutoksen
Ohjaus malarian trooppisessa Afrikassa on ollut erityisen ongelmallista, koska korkeat nopeudet ja yleisen alhaisen sosioekonominen tasolla. Useat tutkimukset ovat osoittaneet, että hyönteismyrkyllä käsiteltyjen bednets (ITBN) vähentää sairastuvuutta ja kuolleisuutta liittyvät malariaan. Useimmilla alueilla käyttöönotto bednets eivät vaadi suuria Menekinedistämisohjelmille ja niiden käyttö on helppo hyväksyä. Tämä saattaa osittain johtuen vähenemisestä hyttynen haitta puree. Jotkut kysymykset on esitetty suhteessa siihen taloudellista kestävyyttä bednet ohjelmia. On tarpeen uudelleen hoitoon bednets hyönteismyrkyllä ajoittain ja bednets on korjattava ja vaihtaa ne tulevat revitty ja kuluvat. Lisäksi jotkut ovat ilmaisseet huolensa pitkän aikavälin hyödyt bednets koska ne vähentävät altistumista, mutta älä poista sitä. Tämä altistumisen vähentäminen voi viivästyttää hankinnan koskemattomuuden ja yksinkertaisesti pospone sairastuvuutta ja kuolleisuutta ja vanhemmissa ikäryhmissä.
[Review malarian ohjaus: R.S. Phillips (2001) Nykyinen tila malarian ja mahdollisuudet valvontaa. Clin. Microbiol. Rev. 14: 208.]
Diagnoosi
- tavattu endeemisissä alueella
- oireet: kuume, vilunväristykset, päänsärky, huonovointisuus
- pernan, anemia
- mikroskooppinen osoittaminen loista (verisivelyvalmisteeseen)
- antigeeninosoituksella (esim., BinaxNOW malarian, ParaSight-F, optimaaliset)
- PCR-monistus loisen DNA
Malaria epäillään henkilöitä, joilla on ollut ollessa endeeminen alue ja oireilla sopusoinnussa malaria (ks kliinisiä oireita). Näitä oireita, erityisesti alkuvaiheessa infektio, ovat ei-spesifisiä, ja kuvataan usein influenssan kaltaisia. Kun sairaus etenee, potilas voi esiintyä suurennettu pernan ja / tai maksan ja anemia. Diagnoosi on varmistettu mikroskoopilla. Paksut veritahrat ovat yleensä herkempiä havaitsemiseen loisia, kun taas ohut tahroja ovat parempi lajien tunnistamiseen. (Katso veri-vaiheen morfologia Plasmodium lajeja.) Jos loisia ei löydy ensimmäisessä verisivelyvalmisteeseen on suositeltavaa tehdä ylimääräisiä tahroja välein 6-12 tuntia niin kauan kuin 48 tuntia. Alustava diagnoosi P. falciparum (lukuisia ja yksinomaan rengas vaiheita) voisi olla hätätilanne, etenkin ei-immuuni henkilö. Rapid immunokromatografinen kokeet (eli kastotikut), joka perustuu antigeenin havaitsemiseen ovat myös saatavilla (katso tarkastelu).
Kemoterapia ja lääkeresistenssin
Useat malarialääkkeitä on saatavilla. Monet tekijät ovat mukana päättämässä paras hoito malarian. Näitä tekijöitä ovat loislajeja vakavuus sairaus (esim., Monimutkainen), potilaan iästä ja immuniteetti, loisen alttius huumeiden (eli lääkeresistenssin), ja kustannukset sekä huumeiden saatavuus. Siksi tarkka suositukset usein vaihtelevat maantieteellisellä alueella. Lisäksi erilaiset lääkkeet toimivat eri tavoin sen elinkaaren eri vaiheissa (taulukko). Muut linkit kohteita:
- Mekanismeja lääkkeen toiminta ja kestävyys
- Virtuaalinen Merivoimien Sairaala, tietoa hoidon ja malarialääkkeet
- WHO, opas anti-malalarial käyttö
- Lääketieteellinen kirjain artikkeli lääkkeitä loisinfektioihin
| Valitut malarialääkkeitä | |
| Huumeiden luokka
Nopeavaikutteinen verta schizontocide Hitaita verta schizontocide Veri + lievä kudos schizontocide Tissue schizontocide (anti-relapsoiva) Gametocidal Yhdistelmät |
Esimerkit
klorokiinia (+ muut 4-aminokinoliineja), kiniini, kinidiini, meflokiini, halofantriini antifolaatit (pyrimetamiini, proquanil, sulfadoksiini, dapsoni), artemisiinipohjaisten johdannaiset (qinghaosu) doksisykliini (+ muut Tetrasykliiniantibiooteille) proguaniilin, pyrimetamiini, tetrasykliinit primaquine
primakiinia, artemisiinipohjaisten johdannaisia, 4-aminokinoliinit (rajoitettu?) Fansidar (pyrimethamine + sulfadoxine), Maloprim (pyrimethamine + dapsone), Malarone (atovaquone + proquanil) |
Nopeavaikutteista verta schizontocides, jotka vaikuttavat veren vaiheessa loisen, joita käytetään akuutin infektioiden ja nopeasti lievittää kliinisiä oireita. Chloroquine on yleensä suositeltu hoito potilailla, joilla P. vivax, P. ovale, P. malariae ja mutkaton klorokiinisensitiiviseen P. falciparum infektioita. Klorokiini on turvallinen ja yleensä hyvin siedetty. Haittavaikutuksia ovat kutina (ts kutina), pahoinvointi, tai levottomuus. Infektiota sairastavilla potilailla joko P. vivax tai P. ovale, ja jotka eivät ole suuri riski tartuntoja, tulisi myös käsitellä primakiiniin (kudoksen schizontocide). Primakiini tehoaa maksan vaiheessa loisen, kuten hypnotsoiitteihin (ks pahenemisvaiheita), ja estää tulevia pahenemisvaiheita. Yhdistelmä klorokiini ja primakiinin kutsutaan usein “radikaali hoito”.
Vaikea, tai monimutkaisia, falciparum malaria on vakava sairaus, jossa on korkea kuolleisuus ja on pidettävä hengenvaarallisia, ja siten vaatii välitöntä hoitoa. Hoito vaatii tyypillisesti parenteraalista lääkkeen annon (ts injektiot), koska potilaat ovat usein koomassa tai oksentelua, ja näin ollen voi ottaa lääkkeitä suun kautta. Parenteraaliset formulaatiot ovat saatavilla klorokiini, kiniini, kinidiini ja artemisiinipohjaisten johdannaisia. Artemisiinipohjaisten johdannaiset ovat yleensä ensisijainen vaihtoehto, mutta ei ole vielä hyväksytty kaikkialla. Esimerkiksi Yhdysvalloissa kiniini ja kinidiini ovat hyväksyttyjä lääkkeitä vaikean malaria. Potilaita on jatkuvasti tarkkailtava hematokriitin, parasitemialla, nesteytys tasot, hypoglykemia, ja merkkejä huumeiden myrkyllisyys ja muiden komplikaatioiden aikana hoidon. Siirtymistä suun kautta olisi heti, kun potilas kykenee. Useimmat kuolemista johtuu vakavasta malarian esiintyä tai lähellä kotia tilanteissa, joissa potilaille ei voida ottaa sairaalaan. Artemisiinipohjaisten peräpuikkoina joka voidaan antaa kyläterveydenhoitajaa on myös kehitetty ja ne ovat osoittautuneet turvallisiksi ja tehokkaiksi.
Teho klorokiinin on suuresti vähentynyt, jonka laajalle levinnyt klorokiini vastus P. falciparum ja syntyminen klorokiinin vastustuskykyisten P. vivax. Jos klorokiini hoito ei tehoa tai jos alueella, jossa klorokiinin vastustuskykyisten malarian, yhteiset vaihtoehtoiset hoidot ovat: meflokiini, kiniini yhdessä doksisykliini tai Fansidar®. Johdannaiset artemisiinipohjaisten (dihydroartemisiniini, artesunate ja artemeetteriä) käytetään yhä enemmän Aasiassa ja Afrikassa ja nyt suosittelevat ensimmäinen rivi hoitoa Maailman terveysjärjestön. Nämä lääkkeet alun perin peräisin koiruoho kasvi (Artemesia annua) ja niitä on käytetty jo pitkään Kiinassa yrttiteetä nimeltään quinhaosu hoitoon kuumeinen sairauksia. Estämään korkeat uudelleen puhkeaminen hinnat liittyy artemisiinipohjaisten johdannaiset ja hidastaa lääkeresistenssin kehittymisen suositellaan hoidon yhdistää liity malarialääkkeet. Drugs käytetään yhdessä artemisiinipohjaisten kuuluvat meflokiini, lumefantriini, Fansidar®, ja amodiaquine.
Estolääkityksen. Kemoprofylaksia on erityisen tärkeää henkilöille ulkopuolisten malaria- alueille, jotka vierailevat alueille, joissa esiintyy malariaa. Tällaisia ei-immuuni henkilöt voivat nopeasti kehittää vakavia ja hengenvaarallisia sairaus. Kuten hoidon ei ole olemassa standardia suositus ja valintoja kemoprofylaksia ovat erittäin riippuvaisia ehdot liittyvät matka- ja HENKILÖKOHTAISET henkilö. (Katso CDC tietosivu malarian ennaltaehkäisyyn.) Kemoprofylaksia edellyttää ei-myrkyllisiä lääkkeitä, koska nämä lääkkeet otetaan pitkien ajanjaksojen ajan. Yleensä potilas alkaa ottaa huumeita ennen matkaa ja sitten jatkaa ottaen huumeiden aikana oleskelun endeeminen alueelle ja jatkaa ottaen huumetta palattuaan. Tämä on vakuuttaa lääkeaine pysyy riittävän korkeana koko ulos vierailun ja suojaamaan tartunnan saatu vierailun aikana. Valitettavasti monet tehokas ja ei-myrkyllisiä lääkkeitä (esim, klorokiini, pyrimetamiini, proquanil) käyttö on rajoitettu, koska lääkeresistenssin. Toinen strategia on perusteltua olettaa (tai “valmiustila”) hoitoon käytettävä yhdessä ennaltaehkäisyyn. Tässä tapauksessa henkilö joko luopuu ennaltaehkäisyyn tai ottaa klorokiini tai muu suhteellisen myrkytön lääke ennaltaehkäisyyn ja kuljettaa huumeiden kuten fansidaria, meflokiini tai kiniini, jotka ne ottavat, jos ne alkavat näytteille oireita malaria.
Käyttö meflokiinin malarian estolääkityksen on hieman kiistanalainen. Meflokiini on tehokas estämään malarian yhdellä tekee viikossa, mikä tarjoaa etuja lääkkeitä, jotka on tarkoitus antaa päivittäin. Tällä annostuksella meflokiini on siedetty suurimmalla osalla yksilöitä. Kuitenkin jotkut ihmiset kokevat neuropsykiatrisia kielteisiä vaikutuksia, kuten unihäiriöitä ja painajaisia. Tämä voi pahentaa kansainvälinen matka, joka on stressaava tapahtuma. Satunnaistettu, sokkoutettu ja controled tutkimukset osoittavat, että neuropsykiatrisia haitallisia vaikutuksia ovat vain hieman suurempi meflokiini kuin muilla malarialääkkeet.
Tappaminen exoerythrocytic vaiheessa (toisin sanoen maksan) estäisi verenmyrkytys ja tunnetaan syy ennaltaehkäisyyn. Tämä on erittäin toivottavaa, että se rajoittaa aikaa profylaktista lääkettä on otettava ennen ja jälkeen matkustaa endeeminen alueelle. Ainoa käytettävissä oleva lääke syy ennaltaehkäisyyn on primakiiniin. Kuitenkin malaria ennaltaehkäisyyn ei ole hyväksytty käyttöön primakiinin ja saa määrätä vain ennaltaehkäisyyn tapauskohtaisesti tapauskohtaisesti. Esimerkiksi henkilöille, jotka usein matkoja lyhytkestoisia erittäin endeemisillä alueilla ja että henkilö ei esittele glukoosi-6-fosfaattidehydrogenaasin puutos. Tafenoquine on parhaillaan kentällä arviointi sen käyttöä syy ennaltaehkäisyyn.
Katsauksia malarian hoitoon:
- Pasvol G (2006) The komplisoituneiden ja vakavan malaria. Br Med Bull 75-76: 29-47.
- Newton P ja White NJ (1999) Malaria: uutta kehitystä hoitoon ja ehkäisyyn. Annu Rev Med 50: 179.
- Valkoinen NJ (1996) malarian hoitoon. N Engl J Med 335: 800.
- Valkoinen NJ (2008) Qinghaosu (Artemisiinipohjaisten): The Price of Success. Science 320, 330-334.
Lääkeresistenssin
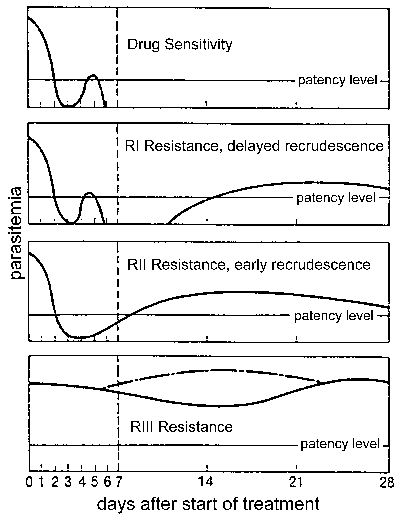 Lääkeresistenssin, ja erityisesti, klorokiinin vastus on merkittävä kansanterveydellinen ongelma valvonnassa malaria. Lääkeresistenssi määritelty hoidon epäonnistumisen ja voidaan luokitella eri tasoilla riippuen ajankohdasta uudelleen puhkeaminen hoidon (kuva). Perinteisesti nämä tasot lääkeresistenssin on määritelty herkkä (ei uudelleen puhkeaminen), RI (viivästynyt uudelleen puhkeaminen), RII (varhainen uudelleen puhkeaminen), ja RIII (vähän tai ei anti-loinen vaikutus). Modifioitu protokolla perustuu kliiniseen tulokseen otettiin käyttöön WHO vuonna 1996. Tässä pöytäkirjassa vastuksen tasoa ilmaistaan riittävän kliinisen vasteen (ACR), myöhäinen hoidon epäonnistuminen (LTF), tai varhainen hoidon epäonnistuminen (ETF), kuten on määritelty seuraavissa :
Lääkeresistenssin, ja erityisesti, klorokiinin vastus on merkittävä kansanterveydellinen ongelma valvonnassa malaria. Lääkeresistenssi määritelty hoidon epäonnistumisen ja voidaan luokitella eri tasoilla riippuen ajankohdasta uudelleen puhkeaminen hoidon (kuva). Perinteisesti nämä tasot lääkeresistenssin on määritelty herkkä (ei uudelleen puhkeaminen), RI (viivästynyt uudelleen puhkeaminen), RII (varhainen uudelleen puhkeaminen), ja RIII (vähän tai ei anti-loinen vaikutus). Modifioitu protokolla perustuu kliiniseen tulokseen otettiin käyttöön WHO vuonna 1996. Tässä pöytäkirjassa vastuksen tasoa ilmaistaan riittävän kliinisen vasteen (ACR), myöhäinen hoidon epäonnistuminen (LTF), tai varhainen hoidon epäonnistuminen (ETF), kuten on määritelty seuraavissa :
- ACR, puuttuminen parasitemialla (riippumatta kuume) tai vaikka kliinisiä oireita (riippumatta parasitemia) päivänä 14 seurannan
- LTF, ilmestyminen oireiden tai läsnäolon parasitemia aikana päivinä 4-14 seurannan
- ETF, pysyvyys kliinisten oireiden läsnäollessa parasitemia 3 ensimmäisen päivän seurannan
Joko protokollaa voidaan käyttää määrittämään lääkeresistenssi, mutta kliininen tulos protokolla on käytännöllisempi alueilla voimakkaan lähetyksen, jossa se voi olla vaikea erottaa uudelleen tartunnan uudelleen puhkeaminen ja missä parasitemialla ilman kliinisiä oireita on yhteinen. Lääkeaineresistenssi joko protokolla määritetään in vivo testeissä, joissa potilaat ovat sairaalahoidossa ja seurataan ja tavanomaisia lääkehoitoa. Myös in vitro testejä, jotka voivat arvioida taso lääkeresistenssi määrittämällä tehoa lääkkeiden vastaan P. falciparum viljelmässä (katso Lääkeresistenssin: Malaria at WHO). In vivo ja in vitro -testit eivät aina vastaa koska isäntä koskemattomuutta ja muut tekijät voivat vaikuttaa in vivo tuloksia. Tunnistaminen spesifisiä mutaatioita, jotka saattavat liittyä lääkeresistenssin (katso taulukko muissa sivulla) saattaa myös johtaa kehitystä perustuvat testit molekyylimarkkereina.
Lääkeaineresistenssi kehittyy, kun loiset on alentunut herkkyys malarialääkkeitä valitaan alla huumeiden paineessa. Vähentynyt lääke herkkyyttä voidaan siirrettävä useilla mekanismeilla (katso Mekanismit lääkeresistenssin) ja heijastaa geneettinen mutaatio (t) tai polymorfismit loispopulaatio. Lääke-resistenssi loiset on selektiivinen etu lääkkeen herkkä loisia lääkkeen läsnä ollessa, ja ne edullisesti lähetetään. Suurimmat tekijät lääkeresistenssin kehittymisen ovat käytön subterapeuttisilla annoksia lääkkeitä tai täyttämällä hoito (taulukko). Alempi lääkkeen tasot poistaa herkimmin loiset, mutta ne, jotka sietävät lääkettä toipuu ja lisääntyä. Ajan mittaan tämä johtaa jatkuva valinta loisia, jotka voivat sietää jopa korkeampia annoksia huumetta. On ratkaisevan tärkeää säilyttää riittävä lääkkeen pitoisuus riittävän aikaa kokonaan poistaa loisia tahansa yksittäisen.
| Tekijöitä kehittäminen ja levittää lääkeresistenssin | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
- Boland PB (2001) Drug vastus malaria. WHO / CDS / CSR / DRS / 2001,4
- Hyde JE (2007) Drug kestävä malaria – käsityksen. FEBS Journal 274, 4688-4698.
- Warhust D (2001) Uudet suunnat: klorokiini-resistenssi Plasmodium falciparum. Drug Resistance Updates 4: 141.
- Wellems TE ja plowe CV (2001) Chloroquine kestävä malaria. J Inf Dis 184: 770.
- Wongsrichanalai C, Pickard AL, Wernsdorfer WH ja Meshnick SR (2002) Epidemiology lääkkeille vastustuskykyisten malarian. Lancet Infect Dis 2: 209.

Comments are closed, but trackbacks and pingbacks are open.