Source: http://www.tulane.edu/~wiser/protozoology/notes/intes.html#giardia
| lumenin-asunnon alkueläimiä |
|---|
Siimalevistä:
Ameba:
Apicomplexa:
Microsporidia:
Other:
|
Lukuisat alkueläimet elävät ruoansulatuskanavan ihmisten (katso laatikko). Luettelo sisältää edustajia monia erilaisia alkueläin ryhmiä. Suurin osa näistä alkueläimiä ovat ei-patogeenisia commensals tai johtaa vain lievän taudin. Jotkut näistä organismit voivat aiheuttaa vakavaa sairautta tietyissä olosuhteissa. Esimerkiksi Giardia lamblia voi aiheuttaa vakavia akuutteja ripulia, joka voi johtaa krooninen ripuli ja ravitsemus; Suoliameba voi tulla erittäin virulenttia ja invasiivisia organismi, joka aiheuttaa hengenvaarallisia systeeminen sairaus. Apicomplexa ja microsporidia lajien (käsitellään toisaalla), jotka normaalisti eivät herättää vakavaa sairautta, voi aiheuttaa vakavia ja hengenvaarallisia ripulin AIDS-potilaiden ja muiden immuunipuutteisilla yksilöitä. Trichomonas vaginalis ei asu sisällä ruoansulatuskanavan, mutta on usein keskusteltu suoliston siimalevät. Se tarttuu virtsa ja ja aiheuttaa sukupuolitauteja tauti.
huono henkilökohtainen hygienia
kehitysmaat
vesiohenteinen epidemioita
male homoseksuaalisuus
zoonoosi?
|
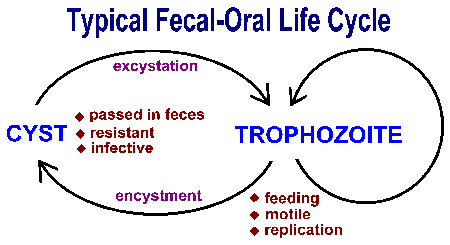
Suoliston alkueläimet lähettävät ulosteen-suun kautta ja yleensä osoittavat samankaltaisia elinkaarta koostuu kysta vaiheessa ja trofotsoiittivaihe vaihe (kuva). Ulosteen suun siirto liittyy ravinnon nielemisen tai saastuttama kystat. Nieltynä sopivalla isäntä, kystat muuntua trophozoites jotka ilmentävät aktiivista aineenvaihduntaa ja ovat yleensä liikkuvia. Loinen vie ravinteita ja läpikäy suvuton replikointi aikana ravintoketjun vaiheessa. Osa trophozoites kehittyy kystia sijasta replikoitumaan. Kystat ominaista kestävä seinä ja erittyvät ulosteeseen. Kysta seinään toiminnot suojaamaan organismin kuivattaminen ulkoisen ympäristön kuin loinen käy läpi suhteellisen lepotilassa ajan odottavat nautittavaksi seuraava isäntä. Tekijöitä, jotka lisäävät todennäköisyyttä ravinnoksi materiaalin saastuttamia ulosteet osansa välittämiseen tämän suoliston alkueläimet (katso laatikko). Yleensä tilanteissa, joissa lähellä ihmisen ihmisten yhteyttä ja unhygenic olosuhteet edistävät lähetyksen.
AIHEET:
- Giardiaasi
- Trichomoniasis
- Dientamoeba fragilis
- Balantidosis
- Amebiasis
- Blastocystis hominis
- Apatogeenisia commensals
Giardiaasi
Giardia lamblia (tunnetaan myös nimellä G. duodenalis, katso huomautukset taksonomia) on alkueläinloisesta että colonizes yläosien ohutsuolessa. Se on maailmanlaajuinen jakelu- ja on yleisin alkueläimen eristetty ihmisen ulosteet. Esiintyvyys on arviolta 200 miljoonaa kliinistä tapausta vuodessa. Itse asiassa se oli luultavasti ensimmäinen symbioottinen alkueläimen koskaan havaittu. On varsin todennäköistä, että Van Leeuwenhoek, keksijä mikroskoopin, ensimmäinen kuvattu Giardia vuonna 1681in omassa ulosteet perustuu hänen kuvaus sen ominaisuuden liikettä. Kuitenkin van Leeuwenhoek koskaan toimitettu piirustukset organismeihin ja Lambl annetaan yleensä luotto tunnistamiseksi Giardia ulosteisiin lapsipotilailla Praque vuonna 1859.
Tyypillisesti Giardia on ei-invasiivisia ja johtaa usein oireeton infektioita. Oireenmukaista Giardiaasi on ominaista akuutti tai krooninen ripuli ja/tai muut maha-suolikanavan oireet.
Elinkaari ja morfologia
Giardia osoittaa tyypillisen fecal suun lähetysjakso (katso edellä). Infektio on hankittu nauttimisesta kystat. Johtavat tekijät saastuminen ruokaa tai vettä, jossa ulosteet korreloivat siirto (laatikko). Esimerkiksi giardiaasi on erityisen suuri lapsilla ja erityisesti lasten laitoksissa tai päiväkodeissa. Kehitysmaissa köyhä puhtaanapito edistää korkeampi Giardiaasi, ja vesi tautitapausten riittämättömien vedenkäsittely on myös dokumentoitu. Backpackers alueilla ei asutuksen uskotaan hankkia juomasta puroihin ja jotkin tiedot viittaavat siihen, että majavat ovat säiliö. Kuitenkin zoonoottista siirto Giardia on kiistanalainen ja ei ole yksiselitteisesti osoitettu. On epäselvää, onko Giardia lamblia edustaa yksittäistä lajia kykenee infektoimaan erilaisia eläimiä, vai onko jokainen isäntä on oma “lemmikki” Giardia. Näyttöä siitä, että Giardia siirto välillä koirien ja ihmisten on melko harvinaista suosii jälkimmäistä. Molekyyli todisteet viittaavat siihen, että joitakin sellaisia kantoja esiintyy kapeita isäntä vaihtelee taas toiset näytteille leveä isäntä alueet (katso muistiinpanoja taksonomia). Riippumatta siitä, onko niiden aiheuttajien siirto on mahdollinen, henkilö-to-person lähetys on yleisin lähetystavasta ja riskitekijät ovat lähellä ihmisten yhteyttä yhdistettynä unhygienic olosuhteissa.
Nautitusta kysta kulkee mahan ja excystation tapahtuu pohjukaissuolessa. Excystation voidaan indusoida in vitro lyhyt altistus kystat ja happaman pH: n (~ 2) tai muista lähteistä vetyioneja. Tämä altistuminen happamuuden jäljittelee olosuhteet mahan ja luultavasti toimii ympäristön vihje loinen. Flagellarakenneosia toiminta alkaa 5-10 minuutin kuluessa happokäsittelyn ja trofotsoiittivaihe syntyy kautta katkos kysta seinään. Erittely kysta seinän uskotaan välittyvän proteaasit. Trofotsoiittivaihe kokee sytokineesiin (solunjakautumisen ilman ydin- replikointi) 30 minuutin kuluessa toipumassa kysta tuloksena on kaksi binucleated trophozoites.
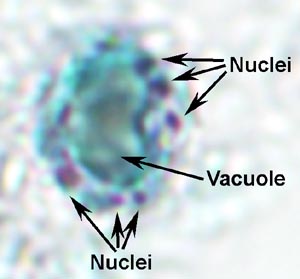
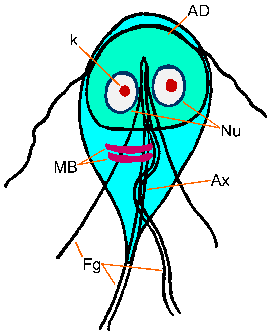 Giardia trofotsoiittivaihe ilmentää ominaisuus päärynä, tai kyyneleen, muoto on molemminpuolinen symmetria katsottuna ylhäältä (kuva). Se on tyypillisesti 12-15 um pitkä, 5-10 pm leveä ja 2-4 pm paksu. Ominaispiirteet värjättyä trofotsoiittivaihe kuuluu: kaksi ydintä (Nu) Keski karyosomes (k), fibrillien käynnissä pituus loisen, ja mediaani elimet (MB). Suuri karyosome ja puute oheislaitteiden kromatiinin antaa ytimien halo ulkonäkö. Fibrillien kutsutaan axonemes (Ax) ja jotka on muodostettu proksimaaliseen alueiden flagella (Fg) sisällä rungon trofotsoiitti. Mediaani elimet ovat pari kaarevan tangon muotoinen rakenteita, jotka sijaitsevat posteriorisesti ytimet. Tällä Mikroskooppitutkimus tasolla mediaani elimet sisältävät erilaisia mikrotubulusten. Toiminto mediaanista elinten ei ole tiedossa, mutta useimmat uskovat jotenkin mukana liiman levyn ja sen muodostumista. Liima-levy (AD), ei ole aina nähtävissä valomikroskoopilla, sijaitsee ventraalisella puolella etupään.
Giardia trofotsoiittivaihe ilmentää ominaisuus päärynä, tai kyyneleen, muoto on molemminpuolinen symmetria katsottuna ylhäältä (kuva). Se on tyypillisesti 12-15 um pitkä, 5-10 pm leveä ja 2-4 pm paksu. Ominaispiirteet värjättyä trofotsoiittivaihe kuuluu: kaksi ydintä (Nu) Keski karyosomes (k), fibrillien käynnissä pituus loisen, ja mediaani elimet (MB). Suuri karyosome ja puute oheislaitteiden kromatiinin antaa ytimien halo ulkonäkö. Fibrillien kutsutaan axonemes (Ax) ja jotka on muodostettu proksimaaliseen alueiden flagella (Fg) sisällä rungon trofotsoiitti. Mediaani elimet ovat pari kaarevan tangon muotoinen rakenteita, jotka sijaitsevat posteriorisesti ytimet. Tällä Mikroskooppitutkimus tasolla mediaani elimet sisältävät erilaisia mikrotubulusten. Toiminto mediaanista elinten ei ole tiedossa, mutta useimmat uskovat jotenkin mukana liiman levyn ja sen muodostumista. Liima-levy (AD), ei ole aina nähtävissä valomikroskoopilla, sijaitsee ventraalisella puolella etupään.
Giardia trophozoites oltava neljä paria siimojen ja ne ovat liikkuvia. Kolme paria siimojen esiin dorsaalipinnalle (anterior, posterior-sivusuunnassa, caudal) ja yksi pari syntyy vatsanpuoleisesta pinnasta. Trophozoites näytteille erottuva arvaamaton kiertämällä, joskus verrattuna putoavaa lehteä. Kuitenkin trophozoites ovat pääasiassa löydetty kiinnitetty epiteelisoluihin ohutsuolen (erityisesti pohjukaissuoli ja tyhjäsuolen) ja ne harvoin löytyy ulosteet, paitsi niissä tapauksissa, vakavan ripulin. Tämä kiinnitys suolen epiteelin välittyy organelle on ventraalisella puolella loisen kutsutaan tarralevy (katso alla). Trofotsoiittivaihe imee ravinteita suolistossa kautta pinosytoosilla eikä erikoistunutta ruokinta organelles on kuvattu.
Trofia vaihe on myös ominaista suvuton replikointi. Molemmat ytimet jakavat suunnilleen samaan aikaan ja sytokineesiin palauttaa binucleated tilassa. Jokainen tytärsolu saa yhden kopion jokaisesta ytimeksi. Molemmat ytimet näkyvät yhtä suuri Suhteen geenien ilmentymistä ja muita ominaisuuksia.
 Vaihtoehtona replikointi trofotsoiitti voi encyst. Aikana encystment loinen pyöristää ylöspäin, irtoaa suoliepiteeliin, ja erittää kysta seinään. Encystation voidaan myös suorittaa in vitro. Optimaalinen induktio encystment saadaan riistää trophozoites sapen pH 7 seuraa altistus suurille sapen pH 7,8. Puute sappi neutraalissa pH: ssa jäljittelee edellytykset lima peiton vieressä suolen epiteelisolujen, kun taas altistus suurille sapen lisää emäksinen pH on analoginen suolistossa. Nämä tutkimukset osoittavat, missä määrin Giardia on sopeutunut elämään ruoansulatuskanavassa.
Vaihtoehtona replikointi trofotsoiitti voi encyst. Aikana encystment loinen pyöristää ylöspäin, irtoaa suoliepiteeliin, ja erittää kysta seinään. Encystation voidaan myös suorittaa in vitro. Optimaalinen induktio encystment saadaan riistää trophozoites sapen pH 7 seuraa altistus suurille sapen pH 7,8. Puute sappi neutraalissa pH: ssa jäljittelee edellytykset lima peiton vieressä suolen epiteelisolujen, kun taas altistus suurille sapen lisää emäksinen pH on analoginen suolistossa. Nämä tutkimukset osoittavat, missä määrin Giardia on sopeutunut elämään ruoansulatuskanavassa.
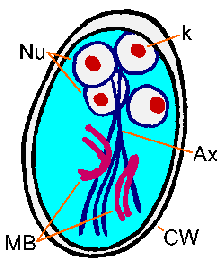
Molekyyli and mikroskooppitutkimus tutkimukset paljastavat synteesiä kysta seinään proteiinien ja ulkonäkö suurten eritysrakkuloiden että loinen sytoplasmassa seuraa induktio encystment. Sen jälkeen kysta seinämänmuodostus loinen käy läpi yhden kierroksen ydinvoiman jako ilman sytokineesiin tuloksena neljä ytimet. Nämä neljä ytimet (Nu) yleensä sijaitsevat etupään kysta (kuva). Flagellaan ja tarralevy menetetään kuin kysta kypsyy, mutta axonemes (Ax) ja mediaani elimet (MB) jatkuu. Erottuva fibrillien (eli axonemes), jotka ulottuvat koko pituudelta kysta, aiheuttaa Giardia on suhteellisen helppo yksiselitteisesti tunnistaa. Kystat ovat soikeita ja tyypillinen toimenpide 11-14 um pitkä ja 6-10 um leveä. Muut ominaisuudet Giardia kystat kuuluu hyvin määriteltyjä seinä (CW), joka on usein erotettu sytoplasmaan loinen. Kystat kulkeutuvat ulosteiden ja voi säilyä jopa kolmeksi kuukaudeksi sopivan lämpötilan ja kosteuden olosuhteissa. Kypsät kystat ovat infektiivisiä seuraavaan isäntä, joka sattuu nielemään niitä, mikä täydentää elinkaaren.
Tarralevyn
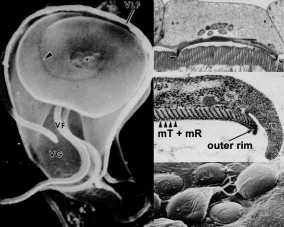
Ainutlaatuinen mikroskooppitutkimus piirre Giardia on tarralevy (kutsutaan myös ventral levy, imee levy, tikkari, tai striated disk). Liima levy on kovera rakenne, joka vie noin kaksi kolmasosaa etummaisen pään ventral pinnan (kuvio, vasen paneeli). Kuten nimet antavat ymmärtää, tämä rakenne on rooli kiinnitys trofotsoiittivaihe suolen epiteeliin ja Mikroskooppitutkimus tutkimukset paljastavat lähellä assosiaatioita tarralevy ja suoliston harjareunusten (kuvio, ylempi oikea paneeli). (Klikkaa tästä suurempi kuva)
Merkittävä osa microribbons ovat proteiineja kutsutaan giardins (aka beta-giardins). Nämä giardins toistaa pääasiassa rakenteellinen rooli muodostumista microribbons. Mielenkiintoista, giardins näyttää rajoitetun homologiaa valkuaisaineen nimeltä Punajuovaisilla kuitu assemblin “päässä Chlamydomonas (vapaa-elävä, bi-flagelloitu- yksisoluisia levät). Vuonna Chlamydomonas tämä proteiini muodostaa rihmamaisia rakenteita pohjan flagella. Giardins ovat kehittyneet pelata eri toiminnallista roolia Giardia, mutta liittyy edelleen mikrotubulusten perustuu sytoskeletaalisiin elementtejä.
Tämä yhdistys proteiinien mukana sukupolven supistusvoiman ja muut solun tukirangan elementtien tarralevy viittaa siihen, että kiinnitys välittyy mekaanisesti luomia voimia loinen. Havainto, että painatuksia ja pyöreän kuvun muotoinen vaurioita jää suoliston harjareunusten (eli mikrovillus) seuraavat irtoaminen trophozoites (kuva, alempi oikea paneeli) on yhdenmukainen supistuvien voimien pelissä rooli liitetiedoston. Muut ehdotetut mekanismit kiinnitys Giardia suolen epiteelin ovat hydrodynaamiset voimat syntyvät ventraalinen siimojen ja reseptorin välittämä sitomalla lektiinejä on trofotsoiitti pinnalle. Kuitenkin flagellarakenneosia liikettä huonosti korreloi kiinnitys ja pinnan lektiinit kattaa koko trofotsoiittivaihe ja eivät erityisesti lokalisoitu tarralevy.
Oire ja patogeneesi
Kliiniset piirteet liittyvät Giardia-infektion välillä yhteensä latenssi (eli oireeton), akuuttiin ohi itsestään ripuli, krooninen oireyhtymät liittyvät ravitsemus, laihtuminen ja epäonnistumisen kukoistaa. Lapset näytteille kliinisiä oireita useammin, että aikuiset ja myöhemmät infektiot ovat yleensä lievempiä kuin alkuperäisen infektioita. Itämisaika on yleensä 1-2 viikkoa, mutta valikoimat 1-75 päivää on raportoitu.
Ensimmäiset merkit Akuutin Giardiaasi ovat pahoinvointi, ruokahaluttomuus ja ylemmän ruoansulatuskanavan levottomuutta. Nämä merkit ovat usein seuraa tai mukana on äkillisen räjähtävän, vetistä, pahanhajuinen ripuli. Uloste liittyvät Giardia-infektion kuvataan yleensä löysä, vieviä, vaahtoava ja / tai rasvainen kanssa ilman verta tai limaa, joka voi auttaa erottamaan giardiaasi muista akuuttia ripulia. Muut ruoansulatuskanavan häiriöitä liittyvät giardiaasi ovat: ilmavaivat, turvotus, ruokahaluttomuus, kouristukset, ja liata rikki- röyhtäilyä (joskus kutsutaan “violetti burbs ‘). Akuutissa vaiheessa yleensä itsestään 3-4 päivää ja usein ei ole hyväksytty Giardiaasi. Joskus kuitenkin, akuutti infektio jatkuu ja johtaa imeytymishäiriö, steatorrhea (liiallinen rasvan väheneminen ulosteissa), voimattomuus (voimattomuus) ja laihtuminen. Jotkut henkilöt ratkaista akuutteja oireita ei poista infektiota, mutta tullut oireeton kysta ohikulkijoita ilman kliinisiä oireita, kun taas toiset voivat olla muutama satunnainen toistuminen on akuutteja oireita.
Akuutit infektiot voivat myös kehittyä pitkäaikainen subakuutti tai krooniset infektiot, jotka harvinaisissa tapauksissa kestää vuosia. Tyypillinen krooninen vaiheessa potilaalla on uusiutuva lyhyt jaksot löysät foul ulosteet, jotka voivat olla kellertävä, vaahtoava ja kellua, mukana suoliston gurgling, vatsan turvotus ja ilmavaivat. Välillä jaksot uloste on yleensä pehmeä, mutta normaali uloste tai ummetus voi myös esiintyä. Krampit ovat epätavallisia kroonisia infektioita, mutta rikki- röyhtäilyä on usein. Ruokahaluttomuus, pahoinvointi, ja ylävatsan levottomuutta täydentävät usein valituksia aikana kroonisia infektioita. Useimmissa kroonisissa tapauksissa loiset ja oireet spontaanisti häviävät.
Erityinen mekanismit Giardia synnyssä johtaa ripuliin ja suoliston imeytymishäiriö ei täysin ymmärretä eikä erityistä virulenssitekijät on tunnistettu. Kiinnitys trophozoites harjaan rajaa voisi tuottaa mekaanista ärsytystä tai limakalvon vauriot. Lisäksi, normaali villus rakenne vaikuttaa joillakin potilailla. Esimerkiksi villus blunting (atrofia) ja krypta solujen liikakasvua ja kasvu crypt perusteellisesti on havaittu vaihtelevasti. Lisäys imukerässoluista johtaa uudelleenmetsitys suolen epiteelin suhteellisen kehittymätön enterosyytteihin alentunut absorptio valmiuksia. Lisääntynyt tulehdussolujen tunkeutuminen lamina propriassa on myös havaittu, ja tämä tulehdus voi liittyä patologian. Giardia-infektio voi johtaa myös laktaasinpuutos (ks laktoosi-intoleranssi alla) sekä muita entsyymi puutteita mikrovillusten. Tämä vähensi ruoansulatus ja imeytyminen liuenneita aineita voi johtaa osmoottisen ripulin ja se voisi myös selittää imeytymishäiriö. Tähän mennessä mikään yksittäinen virulenssitekijäksi tai yhdistävä mekanismi selittää synnyssä Giardiaasi. [Katso myös Patofysiologia ripuli käsitellään yleisesti ripulin.]
Post-Giardia Laktoosi-intoleranssi. Jotkut potilaat voivat esiintyä laktoosi intolerence aktiivisessa Giardia infektioita, jotka voivat jatkua jälkeen loinen puhdistumaan. Tämä kliiniset oireet johtuu loisen aiheuttama laktaasinpuutos ja on yleisintä etnisten ryhmien kanssa alttiudesta laktaasinpuutos. Laktaasi on entsyymi, joka hajottaa laktoosia, sokeria maidossa, monosakkaridit joka voi imeytyä. Tämä laktoosi intolerence oireyhtymä tulisi harkita henkilöille, jotka edelleen esittävät pehmeä uloste ja ilmavaivat hoidon jälkeen, mutta ei ole havaittavaa loisia.
Diagnoosi
Diagnoosi on vahvistettu löytää kystat tai trophozoites ulosteissa tai duodenojejunal ydinaspiraatit tai koepaloja. Havaitseminen loiset voivat olla vaikeaa, koska Giardia ei näy johdonmukaisesti ulosteet kaikista potilaista. Jotkut potilaat ilmentävät korkeita kystat lähes kaikissa uloste, kun taas toiset vain on alhainen loinen laskee joissakin uloste. Sekoitettu malli, jossa kausittain kysta erittyminen vuorottelevat kausia alhainen eritys, on havaittu myös. Lisäksi loiset ovat helpompi löytää aikana akuuttien infektioiden kuin kroonisia infektioita. Aspiraatio ja biopsia voi myös epäonnistua vahvistaa infektion takia hajanainen loci infektion, ja jotkut kysymys hyödyllisyyttä näiden invasiivisia toimenpiteitä.
|
Loisten Osoittaminen |
Ulosteesta tutkiminen
Pohjukaissuolen Ime tai Biopsia
|
Ulosteesta tutkimus on edullinen menetelmä Giardia diagnoosia. Kolme ulosteet otettu välein vähintään kahden päivän olisi tutkittava. Vetinen tai löysät ulosteet voivat sisältää liikkuvia trophozoites jotka ovat havaittavissa välitöntä tutkimista märkä tahroja. Muutoin näyte olisi säilytettävä ja värjätään johtuu trofotsoiittivaihe epävakaisuus. Hardier kystat ovat suhteellisen helppo tunnistaa joko suoraan tai värjättyä tahroja (katso kysta morfologia). Lisäksi, diagnostisia pakkauksia, jotka perustuvat immunofluoresenssilla tai havaitsemiseen Copro-antigeenejä ovat myös saatavilla.
Diagnoosi voidaan tehdä myös tutkimalla pohjukaissuolen nestettä trophozoites. Pohjukaissuolen neste saadaan joko intubaatio tai Enterotest® (kutsutaan myös “string test”). Enterotest® koostuu gelatiinikapselin, joka sisältää nailon merkkijono sopiva pituus. Vapaa pää merkkijonon on teipattu potilaan kasvot ja kapseli niellään. Neljän tunnin yön yli merkkijono haetaan ja sappi-värjätään lima on distaaliosuudesta merkkijono kaavitaan pois ja tarkastelevat tämän märkälevite ja pysyvä värjäytyminen. Pieni suolistobiopsiaa, mieluiten useista pohjukaissuolen ja tyhjäsuolen sivustoja, voi myös paljastaa trophozoites kiinni suoliepiteeliin. [Ohutsuoli on jaettu 3 osaan: pohjukaissuolessa (ensimmäinen tai proksimaalinen osa vatsan jälkeen); jejunumissa (keskimmäinen osa); ja sykkyräsuoli (distaalinen tai viimeinen osa ennen paksusuoli).]
Hoitoa ja valvontaa
Tartunnan saaneet henkilöt tulisi käsitellä, koska Giardia voi jatkua ja johtaa vakavaan imeytymishäiriö ja laihtuminen. Hoito vähentää tehokkaasti sairastuvuuden ja ei ole jälkiseurauksia. Metronidatsoli (Flagyl®), vaikka ei lisensioitu Yhdysvalloissa giardiaasi tehokkaasti tyhjentää loinen (paranemisasteet noin 85%) ja on huume. Suositeltu annos on 750 mg kolme kertaa päivässä viiden päivän ajan (tai vähintään> 3 päivää). Lapsille 15 mg / kg / vrk kolmena annoksena suositellaan. Muita tehokkaita lääkkeitä ovat: quinacrine (Atabrine®), tinidatsolia (Fasigyn®), furatsolidonia (Furoxone®), ja paramomycin (Humatin®). Tinidazole on tehokas yhtenä kahden gramman annos; paramomycin ei imeydy ja se voi olla käyttökelpoinen raskauden aikana.
Laaja levinneisyys Giardia ja infektiivisyyden kystat tekevät epätodennäköistä, että ihmisen infektio poistetaan kokonaan. Ohjaus toimenpiteet, joilla estetään tai vähennetään Giardia infektio riippuu erityisistä olosuhteista lähetyksen, mutta yleensä liittyy toimenpiteitä, jotka estävät nauttiminen aineiden saastuttamaa ulosteet (ks fecal-suullinen siirto tekijät). Terveyden edistäminen ja koulutus, joilla pyritään parantamaan henkilökohtaista hygieniaa, ja korostaa käsien pesu, puhtaanapito ja elintarvikkeiden käsittelyssä, ovat tehokkaita valvontatoimet vähentämiseksi henkilö-to-person siirto. Erityistä huomiota henkilökohtaiseen hygieniaan korkean riskin tilanteissa, kuten päiväkoteja ja muiden laitosten tarvitaan. Hoito oireeton kotitalouden jäsenten ehkäisee tartuntoja ei-endeemisillä alueilla. Kuitenkin arvo kohdella oireeton harjoittajien hyperendemic yhteisöissä on kyseenalainen, koska tartuntoja hinnat ovat korkeat. Sosiaalis-taloudellinen tilanne monissa kehitysmaissa vaikeuttaa tartuntavaaran. Kansanterveys toimenpiteisiin suojellakseen vesihuollon kontaminaatiolta estämiseksi tarvitaan epidemioiden ja vähentää endemisöityminen. Turistit pitäisi juoda vesijohtovettä ilman lisäkäsittelyä paikoissa, joissa puhtaus on kyseenalainen. Kiehuva tai jodi hoito tappaa Giardia kystat, mutta standardi klooraus ei. Ei ole turvallisia tai tehokkaita chemoprophylatic lääkkeitä Giardiaasi.
Trichomoniasis
- Tricomonad morfologia ja laji
- Voimansiirto ja elinkaari
- Oireet ja patogeneesi
- Diagnoosi, hoito ja valvonta
Trichomonads ovat ryhmä flagelloitu- alkueläimet. Suurin osa tämän ryhmän jäsenet ovat lois- ja vain muutama vapaana elävät lajit on tunnistettu. Yleensä Trichomonads ovat ei-patogeeninen commensals ja vain muutamia lajeja ovat tärkeitä eläimillä ja ihmisillä. Neljä lajia Trichomonads tarttua ihmiseen (taulukko). Näistä vain Trichomonas vaginalis on selvästi patogeeninen ja se on yleensä alhainen virulenssi. Toiset näytteille kyseenalainen patogeenisuus.
|
Trichomonads Ihmisten |
||||||||||
|
Trichomonads ovat ryhmä flagelloitu- alkueläimet. Suurin osa tämän ryhmän jäsenet ovat lois- ja vain muutama vapaana elävät lajit on tunnistettu. Yleensä Trichomonads ovat ei-patogeeninen commensals ja vain muutamia lajeja ovat tärkeitä eläimillä ja ihmisillä. Neljä lajia Trichomonads tarttua ihmiseen (taulukko). Näistä vain Trichomonas vaginalis on selvästi patogeeninen ja se on yleensä alhainen virulenssi. Toiset näytteille kyseenalainen patogeenisuus.
Trichomonads ihmisten asuttaa eri anatomisia sijainteja. T. vaginalis on yleinen sukupuolitauti löytyy uro-sukuelinten. T. Tenax, jota kutsutaan myös T. buccalis, on kommensaali ihmisen suuontelon, havaittu erityisesti potilailla, joilla on huono suuhygienia ja kehittyneet parodontiitin. T. Tenax, tai organismille samankaltainen morfologia on myös toisinaan todettiin keuhkoissa. Tällaiset tapaukset ovat raportoitu pääasiassa potilailla, joilla taustalla syöpiä tai muita keuhkosairauksia tai leikkauksen jälkeen. Pentatrichomonas hominis, joka tunnettiin aiemmin nimellä Trichomonas hominis, on ei-patogeeninen kommensaali paksusuolen (katso ei-patogeenisen suoliston siimalevät). Jotkut kirjoittajat jakavat Trichomonads kolmeen sukujen lukumäärän perusteella vapaiden siimoja. Laji kolme siimoja kutsutaan Tritrichomonas, joilla on neljä kutsutaan Trichomonas, ja Pentatrichomonas viittaa Trichomonads viisi ilmainen anterior siimoja. Dientamoeba fragilis alunperin uskotaan olevan ameba (katso ei-patogeenisen suoliston ameba). Nyt on tietää olla ruoskia-odotusten ilman siimoja-liittyviä Trichomonads.
Piirre on Trichomonads on axostyle (ax), joka kulkee pituus organismin ja näyttää työntyä jälkipäähän (kuva). Axostyle on solun tukirangan elementti koostuu samankeskisten riviä mikrotubuleiksi ja uskotaan toimivan kiinnittämisessä loisen epiteelisoluihin. Trichomonads on ominaista 4-6 siimojen (fg) nousemassa etupään. Yksi siimojen on kiinnitetty runkoon organismin ja muodostaa posteriorly-suunnatun aaltoileva kalvo (um), kun taas loput siimoja ovat ilmaisia. Yhdistetyt pohjapinta elimet (bb) ja pohjan aaltoilevaa kalvo, jota kutsutaan Costa (cs), nähdään usein värjätään valmisteet. Harvemmin nähty on cytostomal ura (CY). Yksittäinen ydin (nu) löytyy osoitteesta etupään loisen.
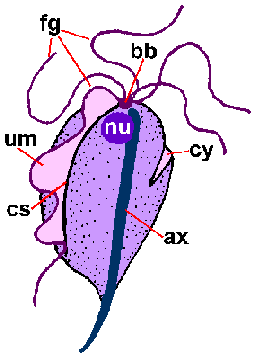
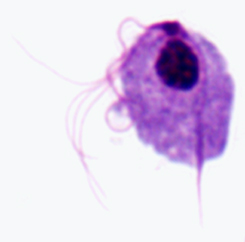
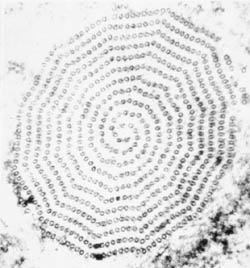
Kaaviokuva suuria rakenteellisia piirteitä trichmonads (vasemmalla). Giemsa-värjättiin trofotsoiittivaihe T. vaginalis in vitro kulttuuri (keskellä). Elektronimikroskoopilla axostyle poikkileikkauksellinen samankeskinen riviä mikrotubulusten (oikealla).
Trichomonads, kuten monet muut suoliston alkueläimet, näytteille anerobic aineenvaihduntaa ja puuttuu mitokondrioita. Osa energia-aineenvaihdunnan ja Trichomonads liittyy ainutlaatuinen organellissa kutsutaan hydrogenosome. Hydrogenosome on kaksinkertainen kalvo ja on etäistä sukua mitokondrioissa. Siltä puuttuu kuitenkin DNA, sytokromeja ja monet tyypilliset mitochnondrial toimintoja, kuten entsyymejä trikarboksyylihapposyklin ja oksidatiivisen fosforylaation. Ensisijainen tehtävä on hydrogenosome on metaboliaan pyruvaatti, tuotettu glykolyysilla sytosoliin asetaatiksi ja hiilidioksidin kanssa samanaikaisesti ATP: n. Elektronit vapautuminen hapettamalla pyruvaatin siirretään vetyioneja tuottaa molekulaarista vetyä, joten nimi hydrogenosome.
Trichomonas vaginalis
Trichomonas vaginalis kuvattiin ensimmäisen päässä märkivä vaginaeritteessä 1836 ja alkupuolella kahdennenkymmenennen vuosisadan tunnustettiin etiologinen vaginiitti. Trichomoniasis on yleinen sukupuolitauti, jossa on maailmanlaajuinen jakelu ja arviolta 167 miljoonaa ihmistä tartunnan vuodessa maailmanlaajuisesti ja 5 miljoonaa uutta tartuntaa vuodessa Yhdysvalloissa. Trichomoniasis uskotaan olevan yleisin ei-virusperäinen Sukupuolitauti. Huolimatta taajuus trichomoniasis se on aiemmin pidetty enemmän haittaa loinen sijaan merkittävä taudinaiheuttaja. Kuitenkin se on nyt tunnustettu tekijä edistettäessä HIV-infektion (katso laatikko), joka aiheuttaa alhaisen painon ja ennenaikaisia synnytyksiä, ja altistavia naisia huomattavaa epämukavuutta ja stressiä.
|
Trichomonas ja HIV |
| Patologian aiheuttamat Trichomonas voivat tehostaa HIV-tartuntojen (1). T. vaginalis infektio tyypillisesti aikaan paikallisen soluvälitteisen immuunivasteen kanssa tulehdus emättimen epiteelin ja kohdunkaula naisilla ja virtsaputken miehiä. Tämä tulehdusreaktio kuuluu soluttautuminen potentiaalisen HIV kohdesolujen kuten CD4 + laakeri lymfosyytteihin ja makrofageihin. Lisäksi T. vaginalis voi aiheuttaa pistemäistä verenvuotoa päälle emättimen seinämät ja kohdunkaula. Tämä leukosyyttien infiltraatiota ja sukupuolielinten vauriot voivat lisätä kohdesolujen viruksen ja mahdollistavat suoran viruksen pääsyn verenkiertoon kautta avoimen vaurioita. Lisäksi verenvuodot ja tulehdus voi nostaa viruksen kehon nesteissä ja numerot HIV-tartunnan lymfosyytit ja makrofagit läsnä sukuelinten alueella henkilöille jo HIV-infektio. Tämä kasvu vapaa viruksista ja virus-tartunnan leukosyyttien voi lisätä todennäköisyyttä hiv altistumisen ja lähetyksen tartuntaa kumppani. Lisääntynyt kohdunkaulan irtoaminen HIV on osoitettu liittyvän kohdunkaulan tulehdus, ja huomattavasti viruskuormaa siemenneste on dokumentoitu miesten trichomoniasis. Koska monet potilaat Trichomonas-infektio ovat oireettomia tai vain lieväoireisten, ne todennäköisesti pysyvät seksuaalisesti aktiivisia huolimatta infektion.
1. Sorvillo F, Smith L, Kerndt P, Ash L. (2001) Trichomonas vaginalis, HIV, ja Afrikkalainen-amerikkalaiset. Emerging Infect Dis. 7: 927-32. |
T. vaginalis, nimestään huolimatta, tarttuu sekä miehiä että naisia. Naisilla organismin ensisijaisesti elää emättimen, ja miehillä se on yleensä löytyy virtsaputken, eturauhas- tai lisäkivesten. Elinkaari muodostuu pelkästään trofotsoiittivaihe vaiheeseen, joka tarttuu suorassa kosketuksessa yhdynnässä. Non-venereal siirto on harvinaista, mutta mahdollista, koska trophozoites voi selvitä 1-2 päivää virtsaan ja 2-3 tuntia märällä sienellä. Lisäksi neonatals saanut tartunnan synnytyksen aikana prosessissa. Trophozoites elävät tiiviisti tai kiinnitetty epiteelin virtsa, jossa he jäljitellä binäärilisäyksellä fissio.
Oire ja patogeneesi
T. vaginalis aiheuttaa erilaisia kliinisiä ilmenemismuotoja miehillä ja naisilla ja naisilla (taulukko) ovat todennäköisesti näytteille oireita, jotka ovat yleensä kestää kauemmin. Itämisaika vaihtelee tyypillisesti 4-28 päivää. Naarailla infektio voi esittää lievä emätintulehdus, akuuttia tai kroonista vulvovaginitis tai virtsaputken. Puhkeaminen tai paheneminen oireiden esiintyy yleisesti aikana tai välittömästi sen jälkeen menstration. Yleisin valituksen liittyy T. vaginalis infektio on sitkeä lievä emätintulehdus liittyy runsaasti, epämiellyttävä hajuisia vastuuvapauden, joka on usein mukana polttamalla tai kutinaa. Tämä vastuuvapaus on useimmiten harmaa, mutta voi olla keltainen tai vihreä ja on joskus vaahtoava tai veren värittyneen. Vastuuvapauden vähenee, kun tartunta muuttuu krooniseksi. Monet naiset myös kokevat kivuliaita tai vaikea yhdyntä. Virtsaputken osallistuminen tapahtuu useissa tapauksissa ja on ominaista dysuria (kivulias virtsaaminen) ja usein virtsaaminen.
|
Kliiniset ilmentymät |
|
|
Naaraat |
Urokset |
|
|
| *% tartunnan; **% oireisen |
|
Emättimen epiteelin tapahtuu pääasiassa infektion. Näin emättimen seinämät ovat yleensä punoittava (eli punainen) ja voi näyttää verenpurkaumat (pieni nostamattomassa spot) verenvuotoja. Pistemäinen hemorrhages kohdunkaula, nimeltään mansikka kohdunkaula, havaitaan noin 2% tapauksista. Tämä mansikka kohdunkaula on erottuva patologinen havainto liittyy trichomonasis ei havaittu muita sukupuolitauteja.
Urokset ovat todennäköisesti olla oireeton (50-90%) ja tulehdus yleensä itsestään rajoittuvia. Virtsaputken ja eturauhasen ovat yleisimpiä infektio-. Oireet ovat: virtsaputken vastuuvapauden (vaihtelevat vähäiset ja märkivä), dysuria, ja virtsaputken kutina (kutina). Jotkut miehet kokevat polttamalla heti yhdynnästä.
Tiedetään vain vähän patofysiologiaan liittyvä T. vaginalis infektio, mutta on oletettavasti johtuu vuorovaikutuksesta loinen ja isäntä epiteelisolujen. In vitro tutkimukset osoittavat, että T. vaginalis voi tuhota solujen kontakti riippuvaisella tavalla. Näin ollen adheesio trophozoites epiteeliin uskotaan olevan merkittävä tekijä synnyssä. Useat tarttumista proteiineja on tunnistettu pinnalle trophozoites. Lisäksi erittyvien proteaasien joka voisi olla rooli patogeneesissä on myös tunnistettu.
Diagnoosin, hoidon ja ohjaus
Yleensä kliiniset oireet eivät ole luotettavia, koska ainoa keino diagnoosin jälkeen kliininen esitys on samanlainen muiden sukupuolitautien ja monet potilaat ovat lieviä tai ei lainkaan oireita. Diagnoosi on vahvistettu osoitus trophozoites emättimen, virtsaputken, eturauhasen eritteiden, tai virtsan sedimentissä (seuraavat eturauhasen hieronta). Mikroskooppinen tarkastelu märkä kiinnikkeet tuoreen valkovuoto, mieluiten kerätään tähystimellä on pumpulipuikolla, on käytännöllisin tapa diagnoosi. Näytteet on laimennettava suolaliuokseen ja tutkitaan heti. T. vaginalis tunnistaa sen tyypillisen morfologisia ominaisuuksia (katso edellä) ja sen nopeaa nykivää liikkuvuutta. Näytteet voidaan myös kiinnitettiin ja värjättiin Giemsa tai fluoresoivia väriaineita. Kuitenkin organismi voi olla vaikea tunnistaa on värjätään dioja.
Herkkyys suora havainnointi vaihtelee 40-80%. Siksi in vitro kulttuuria pidetään kultakantaan diagnoosiin huolimatta joitakin rajoituksia. Esimerkiksi pääsy tilat tarvitaan ja organismit vaativat 2-7 päivää kasvun ennen ne havaitaan. Esteettömyysstrategia ongelma on osittain ratkaistu InPouch ™ TV kulttuuri-järjestelmä (Biomed Diagnostics). Tämä on kaupallisesti saatavilla oleva itsenäinen järjestelmä havaitsemiseksi T. vaginalis kliinisistä näytteistä. Vasta-aine ja DNA-testien korkea herkkyys ja spesifisyys kehitetään.
Metronidatsoli (Flagyl®) ja muut nitroimidazolien, kuten tinidatsolia, ovat erittäin tehokkaita vastaan trichomoniasis. Metronidatsoli aktivoidaan hydrogensome on nitroradikaali ionin väli-. Joko yksi kahden gramman annos (85-92% paranemisasteella) tai 250 mg kolme kertaa vuorokaudessa 7-10 vuorokautta (> 95% paranemisasteella) voidaan käyttää. Seksikumppaneita tulisi kohdella samalla estää tartunnoilta. Jotkut lääkeresistenssi on raportoitu, mutta tämä ei ole laajalle levinnyt ongelma. Hoitovirheitä johtuvat yleensä noncompliance tai reinfection.
|
Trichomoniasis kuin STD |
|
Epidemiologia trichomonasis näyttelyitä samoja piirteitä muita sukupuolitauteja (laatikko) ja esiintymistiheys korreloi määrä seksikumppaneita. Lisäksi yhteistyössä infektio muiden sukupuolitautien on yhteinen. On arvioitu, että jopa 25% seksuaalisesti aktiivisia naisia tulee tartunnan jossain vaiheessa elämäänsä, ja tauti välitetään 30-70% heidän miespuoliset kumppanit. Toimenpiteet valvonnassa käytettyjen muiden STD, kuten rajoittamalla määrä seksikumppaneita ja kondomien käyttöä, ovat myös tehokkaita estämään trichomoniasis.
Katsauksia Trichomoniasis:
Lehker, M. W. ja Alderete, J. F. (2000) Biologiaa of trikomoniaasi. Nykyinen mielipide tartuntataudit 13, 37-45.
Petrin, D., Delgaty, K., Bhatt, R., Garber, G. (1998) Kliininen ja mikrobiologiset näkökohdat Trichomonas vaginalis. Clin. Microbiol. Ilm 11: 300-317.
Schwebke, J. R. ja Burgess, D. (2004) Trichomoniasis. Kliinisen mikrobiologian sta 17, 794-803.
Dientamoeba fragilis
Dientamoeba fragilis kuvattiin alun perin kuin ameba perustuu sen morfologia. Kuitenkin myöhemmin todettiin näytteille morfologia lähempänä kalkkuna loinen Histomonas meleagridis, paitsi puute siimojen. Mikroskooppitutkimus tutkimukset viittaavat myös siihen yhtäläisyyksiä Trichomonads, mukaan lukien hallussaan hydrogenosomes ja molekyylitason tutkimukset ovat vahvistaneet läheinen fylogeneettiseen suhde Dientamoeba ja Histomonas ja mahdollinen distaalisemmissa suhde Trichomonas.
Kuten muidenkin Trichomonads, Dientamoeba vain osoittaa trofotsoiittivaihe vaiheessa (kuva). Tämä herättää kysymyksiä lähetystavasta että kysta vaihe osallistuu tavallisesti ulosteiden suun siirto. Lisäksi trophozoites on Dientamoeba hengissä kehon ulkopuolella hyvin lyhyen aikaa. H. meleagridis puuttuu myös kysta vaiheessa ja on osoitettu, jotka lähetetään munat on sukkulamato. Johtuen läheinen suhde Histomonas ja Dientamoeba, ehdotetaan Dientamoeba on myös lähetetään suolimadon munia. Epidemiologiset ja kokeellista näyttöä taipumus rikosoikeudelliseen pinworm Enterobius vermicularis kuin kantajana Dientamoeba. Viime aikoina, siat on osoitettu olevan luonnollinen isäntä D. fragilis saman genotyypin kuin todettu ihmisillä, mikä nostaa mahdollisuutta zoonoottista lähetyksen (Cacciò et ai, Emerging Infect Dis 18 (5): 838-841, 2012).
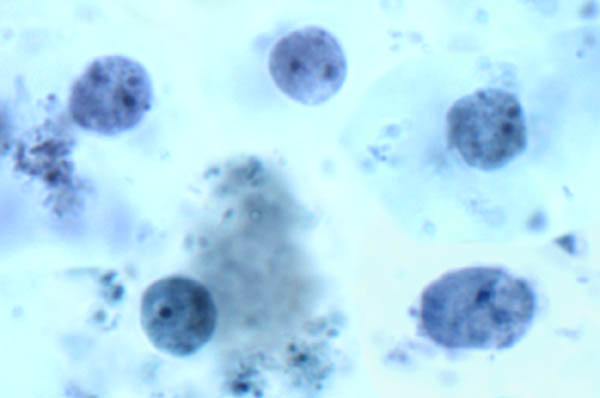
Historiallisesti Dientamoeba on pidetty ei-patogeenisen commensal. Kuitenkin, kliinisiä oireita usein korreloi läsnä suuri määrä trophozoites ja hoitoon infektion ratkaisee oireita. Oireiden arvioidaan 15-30% tartunnan yksilöiden. Liittyvien kliinisten oireiden Dientamoeba ovat ajoittainen ripuli, vatsakipu, ilmavaivat, pahoinvointi ja väsymys. Vähän tiedetään synnyssä ja Dientamoeba todennäköisesti toimii heikompilaatuisen ärsyttävä suoliston limakalvojen, joka voi johtaa jonkin verran tulehdusta. Jodikinoli on yleensä huume hoitoon Dientamoeba. Paromomysiinin ja metronidatsoli ovat myös tehokkaita.
Katsauksia Dientamoeba
Johnson et al (2004) Kehittyvät tuntemattomuudesta: biologinen, kliininen ja diagnostinen näkökohtia Dientamoeba fragilis. Clin Microbiol Rev 17: 553.
Barratt JL et al (2011) tarkastelu Dientamoeba fragilis kuljetus ihmisillä useita syitä, miksi tämä organismi tulisi harkita diagnoosi ruoansulatuskanavan sairaus. Gut Mikrobit 2: 3-12.
Balantidosis
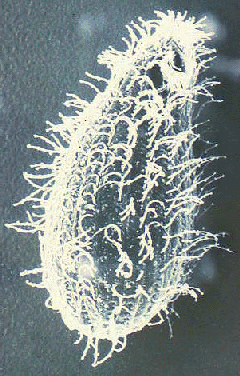 Balantidium coli on ainoa ripsieläin joka tartuttaa ihmisiä. Se löytyy maailmanlaajuisesti, mutta kuten monet muut ulosteen-suun kautta tarttuvat taudit, se on yleisempää tropiikissa. Kuitenkin levinneisyys harvoin yli 1%. B. coli tarttuu myös erilaisia nisäkkäiden ja on erityisen yleinen apinoilla ja sioilla. Esiintyvyys sioilla vaihtelee 20-100% ja ihmisen balantidiosis yleensä esiintyy lisääntynyt esiintyvyys yhteisöissä, jotka elävät tiiviissä yhteistyössä sikoja. Esimerkiksi Filippiinit, jossa siat ovat pääasiallinen kotieläimiä, esiintyvyys keskuudessa sika poromiesten ja teurastamon työntekijät on raportoitu olevan niinkin korkea kuin 28%. Ihmisestä ihmiseen on myös dokumentoitu ja tämä lähetystavasta on todennäköisesti esiintyy ympäristöissä syrjäyttämisen ja huono henkilökohtainen hygienia, kuten psykiatriset sairaalat ja vankilat. (Skip yleinen ripsieläin biologia)
Balantidium coli on ainoa ripsieläin joka tartuttaa ihmisiä. Se löytyy maailmanlaajuisesti, mutta kuten monet muut ulosteen-suun kautta tarttuvat taudit, se on yleisempää tropiikissa. Kuitenkin levinneisyys harvoin yli 1%. B. coli tarttuu myös erilaisia nisäkkäiden ja on erityisen yleinen apinoilla ja sioilla. Esiintyvyys sioilla vaihtelee 20-100% ja ihmisen balantidiosis yleensä esiintyy lisääntynyt esiintyvyys yhteisöissä, jotka elävät tiiviissä yhteistyössä sikoja. Esimerkiksi Filippiinit, jossa siat ovat pääasiallinen kotieläimiä, esiintyvyys keskuudessa sika poromiesten ja teurastamon työntekijät on raportoitu olevan niinkin korkea kuin 28%. Ihmisestä ihmiseen on myös dokumentoitu ja tämä lähetystavasta on todennäköisesti esiintyy ympäristöissä syrjäyttämisen ja huono henkilökohtainen hygienia, kuten psykiatriset sairaalat ja vankilat. (Skip yleinen ripsieläin biologia)
Yleinen ripsieläin biologiaa
Ripsieläimet ovat suuri ja monipuolinen joukko alkueläimet. Useimmat ripsieläimiä ovat vapaana elävät ja löytyy erilaisia elinympäristöjä. Tunnettuja ripsieläimiä sisältävät Paramecium lajeja, joita löytyy lampia kaikkialla maailmassa, ja Ichthyophthirius multifiliis, joka on ectoparasite kalojen joka aiheuttaa valkopilkkutauti (kutsutaan myös ick ‘). Kuten nimi kertoo, ripsieläimet hallussaan cilia jossain vaiheessa elinkaarensa. Värekarvojen on yleensä järjestetty pitkittäisiin riveihin ja tyypillisesti pinnan peittämiseksi organismin. Ripsieläimet on ominaista ydin- dimorphism, että niillä on kaksi erillistä ytimeksi. Suuri munuaisen muotoinen macronucleus on osallisena “taloudenpito” tai somaattisten toimintojen solun, kun taas pienemmät pallomaiset mikronukleus sisältää täydellisen genomin. Macronucleus sisältää tuhansia kopioita kopioinnin suhteen aktiivisia “minikromosomit” edustavat 10-20,000 eri DNA-molekyylit. Näin suuri määrä telomeres (kromosomin päät) johti ripsieläimiä on varhaisen mallijärjestelmä, jolla tutkitaan telomeres ja telomeraasin (entsyymi, joka syntetisoi telomeres).
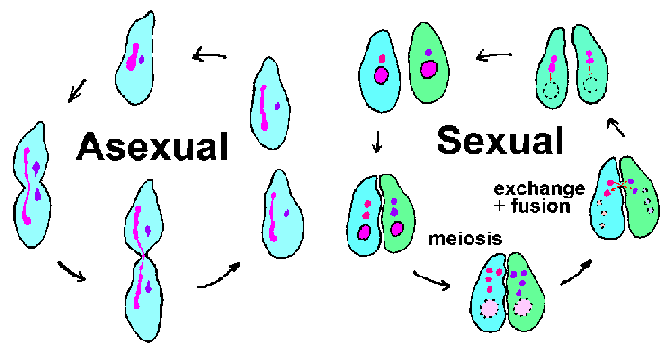
Ripsieläimet tehdään molemmat suvuton lisääntyminen (eli binary fissio) ja suvuton lisääntyminen liittyy konjugaatio (kuva yllä). Konjugaation aikana, kaksi ripsieläimet vastakkaista pariutumisen tyypit pari ja vaihtaa geneettistä materiaalia. Aviollinen kontakti laukaisee meioosia mikrotumissa tuloksena 4 haploid mikrotumia. Samanaikaisesti macronucleus hajoaa ja katoaa. Kolme mikrotumien hajota ja loput mikrotumatesti jakaa uudelleen. Kukin konjugoimiseksi organismien lahjoittaa mikrotumatesti (gametic tai mies) sen mate kautta sytoplasmisen silta, joka yhdistää heitä. Gametic mikrotuma sulakkeita paikallaan (tai nainen) mikrotumatesti muodostavat diploidinen tsygoottisista mikronukleuskokeessa. Conjucating paria erottaa ja tsygoottisista nucluei läpi toisen kierroksen jako. Yksi näistä mikrotumien kehittyy The macronucleus, mikä täydentää sykli. Muodostumista macronucleus liittyy pirstoutuminen kromosomien ja menetys vastaavat DNA-sekvenssit geenejä ei ekspressoidaan korkeilla tasoilla normaalissa suvuton sykli. Jäljellä olevat DNA-fragmentit, tai minikromosomit, vahvistetaan sitten. (Katso kaavio DNA käsittelyn aikana macronucleus muodostumista.)
Balantidosis
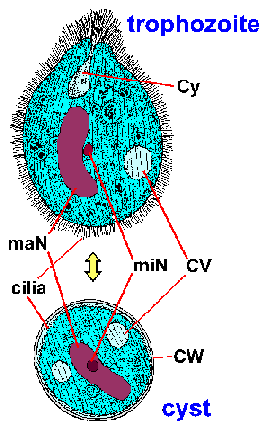 B. coli asuu ei-patogeeninen kommensaali paksusuolessa ja tuottaa mitään oireita. Pinnallinen tulehdus paksusuolen limakalvon voi esiintyä, joka voi aiheuttaa ripulia ja colicky kipua. Lievä tai krooniset infektiot ovat ominaista ajoittainen ripuli ja ummetus, laihtuminen, ja vatsakipu. Harvoissa tapauksissa, trophozoites valtaavat suolen epiteelin ja tuottaa haavaumia. Kliinisesti tämä johtaa akuutin ripulin ja limaa ja verta (eli punatauti). Tämä balantidial punatauti on samanlainen kuin punatauti tuottaman Entameoba histolytica (katso alla). Harvinaiset extra-suolikanavan infektioiden mukana keuhkoihin, emättimen, virtsanjohdin ja virtsarakon ja suolen rei’itys johtaa peritoniitti on raportoitu.
B. coli asuu ei-patogeeninen kommensaali paksusuolessa ja tuottaa mitään oireita. Pinnallinen tulehdus paksusuolen limakalvon voi esiintyä, joka voi aiheuttaa ripulia ja colicky kipua. Lievä tai krooniset infektiot ovat ominaista ajoittainen ripuli ja ummetus, laihtuminen, ja vatsakipu. Harvoissa tapauksissa, trophozoites valtaavat suolen epiteelin ja tuottaa haavaumia. Kliinisesti tämä johtaa akuutin ripulin ja limaa ja verta (eli punatauti). Tämä balantidial punatauti on samanlainen kuin punatauti tuottaman Entameoba histolytica (katso alla). Harvinaiset extra-suolikanavan infektioiden mukana keuhkoihin, emättimen, virtsanjohdin ja virtsarakon ja suolen rei’itys johtaa peritoniitti on raportoitu.
Laboratorion diagnoosi tehdään tunnistamalla organismin ulosteet. Balantidium osoittaa tyypillisen fecal-suullinen elinkaari koostuu trofotsoiittivaihe ja kysta vaiheissa. Suuri koko ja ainutlaatuisia morfologisia ominaisuuksia Balantidium (kuva) on esteenä sen sekaannusta muiden alkueläimiä löydetty ihmisen ulostetta. Trofotsoiitti on munanmuotoinen ja sen keskimääräinen koko on 70 x 45 um, mutta se voi vaihdella ylöspäin 150-200 um. Kysta on erottuva kysta seinään (CW) ja on pallomainen, joiden keskimääräinen halkaisija on 55 pm. Vuonna värjätään yksilöt ilmeisin sisäinen rakenne on suuri macronucleus (mies). Mikrotumatestin (min) ei ehkä aina ole ilmeinen, koska sen tiiviissä yhteistyössä macronucleus. Contractile vacuoles (CV), jotka toimivat osmoottinen asetuksessa, ovat usein nähtävissä ja joskus cytostome (Cy) on havaittavissa. Samanlainen kuin monet muut ripsieläimiä, Balantidium kuuluu riviä värekarvojen. Värekarvat antaa loinen pinnan sumea ulkonäkö ja ovat vähäisempää kysta vaiheessa.
Hoidon valinta on tetrasykliiniä annetaan 500 mg neljä kertaa päivässä 10 päivän ajan. Jodikinoli on suositeltu vaihtoehtoinen lääke. Metronidatsoli ei tuottanut yhdenmukaisia tuloksia. Ehkäisevät toimenpiteet ovat samat kuin muiden sairauksien lähettämää ulosteiden-suun kautta (ks fecal-suullinen siirto tekijöitä tai keskustelua Giardia ennaltaehkäisy). Lisäksi sika viemäröinti olisi pidettävä poissa juomavettä ja ruokaa.
Amebiasis
Useat suvun jäsenet Entamoeba tarttua ihmiseen (katso alla). Näistä vain E. histolytica pidetään patogeenisiä ja tauti se aiheuttaa kutsutaan amebiasis tai amebic punatauti. E. dispar on morfologisesti identtinen E. histolytica ja kaksi oli aiemmin pidetty samaa lajia. Kuitenkin geneettiset ja biokemialliset tiedot osoittavat, että ei-patogeeninen E. histolytica on selvä lajeja (katso keskustelua kriteerit). Kaksi lajia tavataan kaikkialla maailmassa, mutta kuten monet muut suoliston alkueläimet, ne ovat yleisempiä trooppisissa maissa tai muilla alueilla, joilla on huono hygieniaolot. On arvioitu, että jopa 10% maailman väestöstä saa tartunnan joko E. histolytica tai E. dispar ja monissa trooppisissa maissa esiintyvyys voi lähestyä 50%. On arvioitu 50 miljoonaa tapausta amebiasis vuodessa jopa 100.000 kuolemaa.
- Elinkaari ja morfologia
- Patogeneesi
- Mahdolliset mekanismit synnyssä
- Kliininen esittely
- Diagnoosi, hoito ja valvonta
Elinkaari ja morfologia
E. histolytica osoittaa tyypillisen fecal suun elinkaari, joka koostuu tarttuvan kystat kulunut ulosteet ja trophozoites jotka replikoituvat paksusuoleen. Infektio on hankittu nauttimisen kystat ja riskitekijät ovat samankaltaisia kuin muut sairaudet lähettämää ulosteiden-suun kautta (katso taulukko). Saastuneen ruoan ja veden ovat luultavasti ensisijainen tartuntalähteitä. Korkeampi esiintyvyys alueilla alempi sosioekonominen asema johtuu todennäköisesti huonosta hygieniasta ja puute sisätiloissa LVI. Kuitenkin E. histolytica on harvoin syy matkustajien ripuli ja liittyy yleensä pitkäaikaisen (> 1 kk) oleskella endeemiselle alueelle. Korkeampi esiintyvyys E. histolytica infektio on myös havaittu laitoksissa, kuten mielisairaaloissa, orpokodeissa ja vankiloissa, joissa syrjäyttämisen ja ongelmat ulosteen saastuminen ovat vaikuttaneet tekijät. Suuri levinneisyys mies homoseksuaaleja on myös todettu. Ihminen on ainoa isäntä E. histolytica ja ei ole eläinreservuaareista.
 Nielemisen kystat kulkee mahan läpi ja excyst alaosaan ohutsuolen. Excystation liittyy häiriöitä kysta seinän ja quadranucleated ameba syntyy aukon läpi. Ameba suoritetaan toinen kierros ydinvoiman jako seuraa kolme peräkkäiset sytokineesi (eli solunjakautumisen) tuottaa kahdeksan pientä uninucleated trophozoites, joskus kutsutaan amebulae. Nämä epäkypsä trophozoites asuttaa paksusuoleen, erityisesti umpisuolen ja sigmoidorectal alueille, missä ne syövät bakteereja ja solutason roskia ja tehdään useaan kertaan binary fissio.
Nielemisen kystat kulkee mahan läpi ja excyst alaosaan ohutsuolen. Excystation liittyy häiriöitä kysta seinän ja quadranucleated ameba syntyy aukon läpi. Ameba suoritetaan toinen kierros ydinvoiman jako seuraa kolme peräkkäiset sytokineesi (eli solunjakautumisen) tuottaa kahdeksan pientä uninucleated trophozoites, joskus kutsutaan amebulae. Nämä epäkypsä trophozoites asuttaa paksusuoleen, erityisesti umpisuolen ja sigmoidorectal alueille, missä ne syövät bakteereja ja solutason roskia ja tehdään useaan kertaan binary fissio.
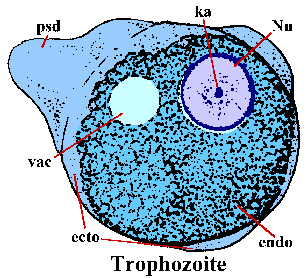
E. histolytica trophozoites on amorfinen muoto ja ovat yleensä 15-30 um. Trophozoites liikkuvat laajentamalla sormimaisen pseudopodium (PSD) ja vetämällä muualle elimistöön eteenpäin (kutsutaan ameboid liike). Valejalka, ja joskus ulkoreunan trofotsoiittivaihe, on selkeä valoa taittava ulkonäkö ja on kutsutaan ektoplasmaa (ecto). Loput solulimassa on rakeinen ja on nimeltään endoplasm (endo). Joskus glykogeenin vacuole (Vac) on ilmeinen. Nuclear (Nu) morfologia värjättyä yksilöt on ominaista hienoksi rakeinen rengas perifeerisen chromatin ja keskeisellä paikalla karyosome (ka).
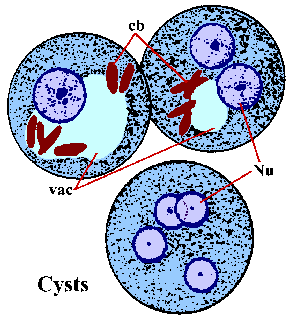 Vaihtoehtona suvuton replikointi trophozoites voi myös encyst. Tekijät vastuussa induktion encystation ei tunneta. Encystation alkaa trophozoites entistä pallomaisia ja ulkonäkö chromatoid elinten sytoplasmassa. Chromatoid elimet (cb) värjätään pitkänomainen rakenteiden kierros päättyy ja edustavat yhdistäminen ribosomien. Kysta seinämä koostuu kitiiniä ja on sileä, valoa taittava ulkonäkö. Kysta kypsyminen on kaksi kierrosta ydin- lisääntymään ilman solujen jakautumista ja kystat 1-4 ytimet (Nu) löytyy ulosteet. N ydinalan morfologia kysta on samanlainen kuin trofotsoiittivaihe paitsi että ytimet tulevat asteittain pienempiä jokaisen jako. Joskus nuoret kystat (eli 1-2 ytimet) tulee olemaan glykogeenin vacuole (VAC), joka näyttää kirkkaalta alue värjätään yksilöitä. Tämä onteloiden joskus syrjäyttää ja muuttaa morfologiaa ytimeksi. Chromatoid elimet pyrkivät kadota kysta kypsyy. Kystat ovat yleensä 12-15 um. Kystat heti infektoiva kun erittyminen ulosteeseen ja on elinkelpoinen viikkoja-to-kuukautta ympäristön olosuhteista riippuen.
Vaihtoehtona suvuton replikointi trophozoites voi myös encyst. Tekijät vastuussa induktion encystation ei tunneta. Encystation alkaa trophozoites entistä pallomaisia ja ulkonäkö chromatoid elinten sytoplasmassa. Chromatoid elimet (cb) värjätään pitkänomainen rakenteiden kierros päättyy ja edustavat yhdistäminen ribosomien. Kysta seinämä koostuu kitiiniä ja on sileä, valoa taittava ulkonäkö. Kysta kypsyminen on kaksi kierrosta ydin- lisääntymään ilman solujen jakautumista ja kystat 1-4 ytimet (Nu) löytyy ulosteet. N ydinalan morfologia kysta on samanlainen kuin trofotsoiittivaihe paitsi että ytimet tulevat asteittain pienempiä jokaisen jako. Joskus nuoret kystat (eli 1-2 ytimet) tulee olemaan glykogeenin vacuole (VAC), joka näyttää kirkkaalta alue värjätään yksilöitä. Tämä onteloiden joskus syrjäyttää ja muuttaa morfologiaa ytimeksi. Chromatoid elimet pyrkivät kadota kysta kypsyy. Kystat ovat yleensä 12-15 um. Kystat heti infektoiva kun erittyminen ulosteeseen ja on elinkelpoinen viikkoja-to-kuukautta ympäristön olosuhteista riippuen.
Synnyssä
E. histolytica usein elää kuin kommensaali sisällä paksusuolen ilman taudin kliinisiä ilmenemismuotoja. Kuitenkin trophozoites voi hyökätä paksusuolen epiteelin ja tuottaa haavaumia ja punatauti (katso laatikko). Tämä invasiivisen sairauden voi tulla asteittain huonompi ja johtaa entistä vakava sairaus. Amebas voi myös etäispesäkkeitä muihin elimiin ja tuottaa anextraintestinal amebiasis. Toisin sanoen, E. histolytica on fakultatiivinen taudinaiheuttaja, joka esittelee monenlaisia virulenssin.
|
Amebiasis eteneminen |
ei-invasiivisia
invasiivisia
|
Ei-invasiivinen tauti on usein oireeton, mutta voi aiheuttaa ripulia tai muiden maha-suolikanavan oireet, kuten vatsakipu tai krampit. Tämä ei-invasiivisia infektio voi jatkua tai edistymisestä invasiivisen sairaus, jossa trophozoites tunkeutua suolen limakalvon ja tappaa epiteelisolujen. Varhainen vaurio on pieni alue kuolion tai haavaumia, tunnettu siitä, että reunat ja käytännössä mitään tulehdusta välillä leesioita (kuvio). Ameba leviää sivusuunnassa ja alaspäin submukoosassa (alla epiteelin) ja tappaa isäntäsolut edetessä. Tämä johtaa klassista “pulloon muotoinen” haavauma, jossa on pieni aukko ja laaja pohja. Trophozoites ovat eniten välisellä rajalla tervettä kudosta ja nekroottista kudosta. Nämä invasiivisia ameba nauttiminen isäntäsoluja ja trophozoites kanssa nautittu punasolujen ovat usein ilmeinen. Nämä hematophagous trophozoites joskus löytyy dysenteric ulosteet. Kysta tuotanto vähenee aikana invasiivisia vaiheessa infektion ja kystat ei koskaan löydetty kudosvaurioihin.
⇑Vasen: luumenin puolella paksusuolen tyrskyävät amebiasis tapauksessa on esitetty useita haavoja. Huomautus reunat (nuoli). Keskellä: Histologinen valmistelu näytetään poikkileikkaus haavauma. Huomaa korkea kuolion keskellä haava. Amebas etenevät sivusuunnassa alle ehjä limakalvon osoittamalla tavalla mikrovillusten. Oikea: Korkeampi suurennos haavauma esitetty useita hematophagous trophozoites. Ydin (nuoli) on ilmeistä yksi amebas. Kuvia Peters ja Gilles (1989), Colour Atlas of Tropical Medicine ja parasitologia (3rd edition).
Haavaisen prosessi voi edelleen laajentaa sivusuunnassa tai alaspäin. Jos suuri määrä haavaumat ovat läsnä, ne voivat kasvaa yhteen, jotka voivat johtaa paikallisen sloughing pois suolen seinämän. Haavauma laajeneminen voi myös tunkeutua serous kerroksen ja johtaa rei’itys suolen seinämän. Tämä lävistys voi aiheuttaa paikallisia paiseita tai yleistynyt peritoniitti. (Katso myös kaavioesitys kudosinvaasio.) Amebic haavaumia voi myös tulla toissijaisesti tartunnan bakteerit, jotka voivat sekoittaa kliinistä kuvaa. Lisäksi, E. histolytica infektio voi joskus johtaa muodostumista amebic granulooman, kutsutaan myös ameboma. Ameboma on tulehduksellinen paksuuntuminen suolen seinämän ympärille haavauma, joka voidaan sekoittaa kasvain.
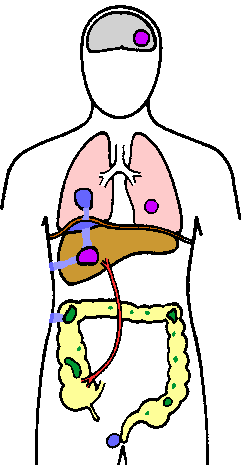
Amebiasis voi myös edetä systeeminen tai suoliston ulkopuolisten infektio. Levittäminen ensisijaiselta suoliston vaurio on pääasiassa kautta verenkiertoon, mutta voi myös tapahtua suoraa jatkoa vaurio. Maksa on yleisimmin vaikuttaa elin ja tämä johtuu todennäköisesti kuljettamisen suoraan trophozoites paksusuolesta maksaan kautta saporttilaskimo (kuva). Aluksi vauriot ovat pieniä pesäkkeitä kuolio, joka yleensä sulautua yhdeksi paise koska ne laajenevat. Tämä maksan paise laajenee edelleen, sillä trophozoites asteittain tuhota ja nielemään isäntäsoluissa. Keskellä paise, joka koostuu hajotettiin hepatosyyttien, punasolujen, sappi ja rasvaa, voi nesteyttää ja tämä nekroottinen materiaali (joskus virheellisesti kutsutaan mätä) vaihtelevat väriltään kellertävän punertavanruskeaan. Toissijainen bakteeri-infektioiden maksassa paise eivät ole yhteisiä (~ 2%).
Hematogenous leviäminen trophozoites muille sivustoille, kuten keuhkoihin tai aivoihin, on harvinaista, mutta ei esiinny. Toiseksi yleisin suoliston ulkopuolisten sivuston jälkeen maksa on keuhkoihin. Keuhkojen infektiot yleensä johtuvat suoraa jatkoa maksan vaurio poikki kalvon ja osaksi keuhkopussin ja keuhkojen. Ihovaurioiden muodostettu seurauksena maksan tai suolen fisteli voi myös esiintyä, mutta erittäin harvinaista. Muita ihovaurioiden kuuluvat peräaukon haavaumat ja osallistuminen sukuelinten, mukaan lukien penis homoseksuaalien. Nämä myöhemmin ilmenemismuodot ovat todennäköisesti johtuu ihon tai limakalvojen kanssa kosketuksiin invasiivisia trophozoites.
Mahdollisia mekanismeja patogeenisuusmekanismien
Kuten edellä todettiin, E. histolytica on taudinaiheuttaja, joka on laajakirjoinen elinvoimaisuuden, jotka vaihtelevat avirulenttia commensal on erittäin invasiivinen ja tuhoisa organismia (ks keskustelua patogeenisuuden vs. virulenssi). Osa tästä erosta virulenssi johtuu olemassaolo morfologisesti samanlaisia, mutta avirulentteja, E. dispar. E. dispar ei ole koskaan liittynyt oireenmukaista invasiivisia sairauksia ja tartunta ei saada seerumin vasta-aineita. Sitä vastoin anti-ameba humoraalivasteiden havaitaan sekä oireettoman ja oireisen E. histolytica infektioita. Tämä viittaa siihen, että jopa oireettomia tapauksia on rajoitettu määrä hyökkäystä. Kuitenkin infektio E. histolytica ei aina johda invasiivisia sairauksia, vaikka, että vain noin 10% tartunnan yksilöiden kehittää oireenmukaista invasiivisia amebiasis. Tekijät vastaavat patogeneesi E. histolytica eivät ole hyvin ymmärretty. Eräs lähestymistapa ymmärtämiseen synnyssä on verrata mahdollista virulenssitekijät näiden kahden lähisukulaislajeihin.
|
Entamoeba esiintyvyyden |
|
Patologian tulokset isäntä-loinenvuorovaikutuksissa, ja siksi, isäntä tekijät, loinen tekijöitä tai molempia voi myötävaikuttaa sairaustilan. Esimerkiksi kehittäminen invasiivisen sairauden voisi johtua määrällisiä tai laadullisia näkökohtia isännän immuunivastetta. Rekrytointi neutrofiilien ja voimakas tulehdus on merkitty alkuvaiheessa amebic hyökkäystä. Kuitenkin tulehdus ympäröivän perustettu haavoja ja paiseita jos usein minimaalinen annetaan aste kudosvaurioita.
isäntäsolugeenit
loinen tekijät
|
Luonne suojaavia immuunivasteita ei ole selvä. Synnynnäinen tai epäspesifinen immuniteetti sekä hankittu immuniteetti, ovat luultavasti molemmat tärkeitä ehkäisyyn invasiivisen sairauden. Limakalvojen peittävä epitheilial solut voivat estää kontakti trofotsoiittivaihe ja isäntäsoluissa. Lisäksi limakalvon IgA vasteita esiintyy seurauksena infektio ja ulosteen IgA vasten trofotsoiittivaihe pintaa lektiini (ks Eh-lektiini) liittyvät harvemmin uusien E. histolytica infektioita. Korkeita tiittereitä seerumin vasta-aineiden myös kehittyä maksan paiseita. Koska invasiivista tautia on usein progressiivinen ja sitkeiden, rooli näiden anti-ameba vasta on kyseessä. Cell-vasteita näyttävät osansa rajoittaakseen invasiivisen amebiasis ja suojata isäntää uusiutumista onnistuneen hoidon.
Kestävyys isännän immuunivaste on toinen mahdollinen virulenssitekijäksi jotka voivat edistää ja pahenemiseen invasiivisen sairauden. Esimerkiksi yksi fenotyyppinen ero E. dispar ja E. histolytica on vastus jolla täydennetään lyysin (katso E. dispar). Lisäksi, E. histolytica hajoaa nopeasti sekretorisen IgA ja mahdollisesti ehkäisee T-solun vasteita E. histolytica antigeenejä. E. histolytica pystyy myös tappaa soluja, mukaan lukien neutrofiilit ja muut immuuniefektorisolujen, joka kontakti riippuvaisella tavalla. Lysis Neutrofiilien voisi vapauttaa myrkyllisiä tuotteita, jotka edistävät tuhoutuminen isännän kudosta. Kuitenkin rooli näiden eri ilmiöiden synnyssä ei ole tiedossa.
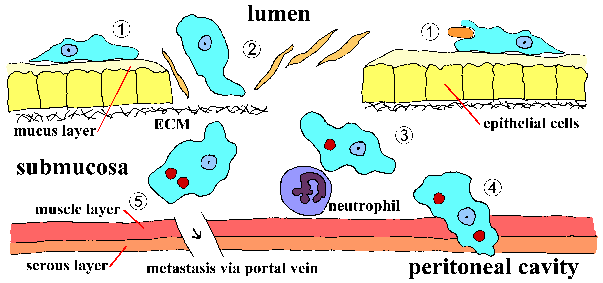
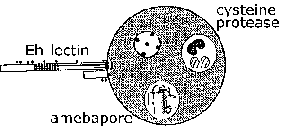
Invasion of suolen limakalvon E. histolytica on aktiivinen prosessi välittyy loinen ja erilliset vaiheet voidaan tunnistaa (kuva, klikkaa tästä suurempi kuva ja yksityiskohtainen legenda). Trophozoites kiinni limakerroksessa (vaihe 1). Tämä sitoutuminen sinänsä luultavasti ei edistä synnyssä ja on yksinkertaisesti mekanismi ameba indeksoida pitkin kasvualusta. Ehtyminen lima este mahdollistaa trofotsoiittivaihe tulla kosketuksiin epiteelisolujen. Epiteelisolut kuolee yhteystiedon riippuvaisella tavalla, joka johtaa häiriöitä suolen limakalvon (vaihe 2). Trophozoites jatkaa tappaa isännän soluihin submukoosassa ja edelleen häiritä kudoksen kuin ne etukäteen (vaihe 3). Häiriöt suolen seinämän (vaihe 4) tai metastaasin verenkierron kautta (vaihe 5) on myös mahdollista. Liittyminen, sytotoksisuus, ja häiriöitä kudokset ovat tärkeitä tekijöitä patogeneesissä E. histolytica. Parasite proteiineja, jotka voisivat olla rooli näissä prosesseissa ovat: Eh-lektiini, amebapore, ja proteaasit.
Eh-lektiini. E. histolytica voivat tappaa soluja muutaman minuutin kiinni niistä läsnäollessa ekstrasellulaarisen kalsiumin. Kiinnittyminen E. histolytica trophozoites isäntäsoluihin ja paksusuolen musiineja välittyy lektiini-aktiivisuus ilmennetään ameba pinnalla. Tämä lektiini sitoutuu galaktoosia tai N-asetyyli-D-galaktosamiinin (GalNAc), joilla on korkea affiniteetti ja sitä kutsutaan myös galaktoosia inhiboitavissa sitoutuminen proteiini (GIAP) tai Gal / GalNAc lektiinin. Kontakti-riippuvaisen tappamisen kohdesolujen inhiboi lähes täydellisesti galaktoosin tai GalNAc ja kohde- soluja, joista puuttuu terminaalinen galaktoositähteitä niiden pintaglykoproteiineja kestävät trofotsoiitti tarttuvuus ja sytotoksisuutta. Tämä viittaa siihen, että Gal / GalNAc lektiini on tärkeä virulenssitekijä. Lisäksi, Eh-lektiini on osallisena vastustuskyvyn täydentää lyysin. Koska sen mahdollisen roolin noudattamista ja virulenssin ja koska ulosteen IgA vastaan suojaa amebic koliitti, Gal / GalNAc on rokotekandidaattia (Petri et al, 2006, Arch. Med. Res. 37: 288).
Eh-lektiini on heterodimeeri, joka koostuu 170 kDa raskaan ketjun ja 31-35 kDa kevytketju liittynyt disulfidisidokset. Välikorotus alayksikköä 150 kDa on kovalenttisesti liittyy heterodimeerin. Raskaan ketjun transmembraanidomeeni ja hiilihydraattia sitovan domeenin. Kaikki alayksiköt koodataan multigeeniryhmiä. On viisi jäsentä raskaan ketjun perhe, 6-7 jäsentä kevyen ketjun perhe ja 30 jäsentä väliketjun perheen. Jäsenet raskaan ketjun geenin perhe näyttelytila 89-95% identtisyys aminohappotasolla tasolla, kun taas kevyt ketju perheenjäsenet ovat vähemmän konservoituneita jakaminen vain 79-85% sekvenssi-identiteetti.
E. dispar ilmaisee myös Gal / GalNAc lektiinin pinnallaan. Sekä E. dispar ja E. histolytica täytyy noudattaa limakalvojen kerros, joka on lääkkeitä, joita Gal / GalNAc lektiinin. Limaa koostuu glykoproteiinien kutsutaan musiineja. Vallitseva musiinin löytyy suoliston limakalvo on Muc2, joka on laajasti glykosyloituja O-kytketty GalNAc tähteitä. Sekvenssi kevyen ja raskaan ketjun geenit E. dispar ovat homologisia, mutta eivät identtisiä, kuin E. histolytica. Antigeeniset erot GIAP E. dispar ja E. histolytica on myös kuvattu, että vain kaksi epitooppia kuudesta jaetaan näiden kahden lajin välillä (katso E. dispar). Ei tiedetä, ovatko nämä sekvenssi erot voivat selittää erot virulenssin välillä E. dispar ja E. histolytica. Sitoutuminen on tietenkin tärkeää sekä lajeja, mutta on mahdollista, että kiinnittyminen on laadullisesti tai määrällisesti eri lajien välillä.
[Katsaus Eh-lektiinin: Petri ym (2002) Annu. Rev. Microbiol. 56:39].
Amebapore. Perhe huokosia muodostavan polypeptidien on havaittu E. histolytica ja E. dispar. Kolme perheenjäsenet nimetty amebapore A, B ja C amebapore olento hallitseva ilmaistu. Kypsä polypeptidi on 77 aminohappoa pitkä ja muodostaa dimeerejä matalassa pH: ssa (4-6). Kolme näistä dimeerien sitten koota onttoon rengasmainen rakenne. Tämä hexamer sitten voi interkalatoi kalvoihin ja esitellä 2 nm huokosia (eli reikää), joka johtaa solun kuolemaan. Huokosia muodostava aktiivisuus riippuu tästä kokoonpano prosessi, joka alkaa dimerointi. Amebabpore A on 95% identtinen (toisin sanoen neljä tähteet ovat erilaisia) välillä E. histolytica ja E. dispar. Lisäksi, E. dispar amebapore on noin puolet huokosia muodostava aktiivisuus kuin E. histolytica amebapore. Tämä ero huokosia muodostavan aktiivisuuden on katsottu johtuvan glutamaatti asemassa 2 E. histolytica amebapore, verrattuna proliinitähde E. dispar amebapore. Tämä erityisesti aminohappotähde on tärkeää muodostumista dimeerien ja uskotaan, että dimeerien E. dispar amebapore ovat vähemmän stabiileja.
Amebapore on lokalisoitu vakuolaarisen osastoihin (esim ruoka vacuoles) sisällä trofotsoiittivaihe ja on kaikkein aktiivinen happamassa viittaa siihen, että tärkeä toiminto amebapore on hajottamiseksi nautittuina bakteereja. Kuitenkin, amebapore on mukana niin virulenssitekijä, että geneettinen manipulointi E. histolytica mikä laski ilmentyminen amebapore johtaa vähenemiseen patogeenisyys (kyky muodostaa maksan paiseet) sekä vähentää bakteereille aktiivisuus (Bracha et ai, Mol. Microbiol. 34: 363, 1999). Samoin muokattu E. histolytica täysin vailla amebapore tuotannon eivät kykene muodostamaan maksan paiseita mallissa järjestelmissä (Zhang et al, Inf. Imm. 72: 678, 2004). Nämä amebas pystyvät aiheuttaa tulehduksen ja kudosvaurioita malleja amebic koliitti.
[Katsaus amebapore: Leippe et ai, Tr. Parasitol. 21: 5, 2005.]
Proteaasit. Proteaasit ovat entsyymejä, jotka hajottavat muihin proteiineihin ja saattaa myötävaikuttaa patogeneesiin syy E. histolytica. Tässä suhteessa, E. histolytica ilmaisee ja erittää korkeampi kysteiiniproteaasien, erityisesti luokan proteaasi, kuin E. dispar. Kysteiiniproteaasien on osoitettu häiritä polymerointia MUC2, pääkomponenttina paksusuolen limaa. Tämä huonontunut lima on tehottomampi estämisessä tarttuminen trophozoites epiteelisoluihin. Tuhoaminen soluväliaineen (ECM) proteaasien voi myös helpottaa trofotsoiittivaihe hyökkäystä. Inhibiittorit kysteiiniproteaasien voi pienentää maksan paise koko kokeellisissa malleissa.
Kaksikymmentä eri kysteiiniproteaasiin geenit on tunnistettu E. histolytica. Ortologeja kaksi E. histolytica kysteiiniproteaasi geenejä ei löydy E. dispar. Yksi näistä, nimetyn CP5, ilmentyy korkeilla tasoilla on trofotsoiittivaihe pinnalla. Mutantit ilmentävät alhaisempi CP5 oli alentunut kyky tuottaa maksan paiseita hamsterin amebiasis malli. Nämä mutantit oli myös alennettu kasvuvauhti ja alempi erythrophagocytic toimintaa, joten ei ole selvää, onko CP5 suoraan osallistuu invasiivisuus E. histolytica. Lisäksi esto 90% CP5 toiminta ei vaikuttanut kykyyn E. histolytica trophozoites tuhota yksisolukerroksista vitro. CP1, CP2, ja CP5 ovat runsaimmin ilmaistu kysteiiniproteaaseista E. histolytica, kun taas CP3 on yleisin E. dispar. Mielenkiintoista, yli ilmentyminen CP2 E. dispar lisääntynyt kyky trophozoites tuhota yksisolukerroksista vitro. Kuitenkin yli ilmaus CP2 ei johtanut kykyä E. dispar muodostamaan maksan paiseita antilooppirotilla. Siksi ei ole selvää täsmällistä roolit proteaasit voivat olla synnyssä.
Yhteenvetona synnyssä liittyy E. histolytica infektio johtuu pääasiassa sen kyky tunkeutua kudoksiin ja tappaa isäntäsoluissa. Useita mahdollisia virulenssitekijöitä on tunnistettu (katso taulukko). Ei kuitenkaan ole selvää tarkkaa roolia näiden eri virulenssitekijät pelata kehittämisessä invasiivisen sairauden. Eräs lähestymistapa ymmärtämiseen synnyssä on vertailla näiden tekijöiden E. histolytica ja E. dispar. Nämä kaksi lajia ovat läheistä sukua ja mahdolliset virulenssitekijät löytyy molemmilla lajeilla. Liittyminen, sytolyyttinen aktiivisuus ja proteolyyttinen aktiivisuus on luonnostaan biologisia piirteitä sekä lajien ja nämä toimet eivät välttämättä johda patologian. On kuitenkin olemassa laadullisia ja määrällisiä eroja E. histolytica ja E. dispar mikä voi selittää erot virulenssi. Nämä geneettiset erot E. histolytica ja E. dispar osoittavat, että patogeneesi on osittain luontainen ominaisuus loisen. Kuitenkin patogeneesi johtuu todennäköisesti yhdessä vaikutukset useiden isäntä ja loinen tekijät, ja virulenssi voi edustaa määrin isäntä voi ohjata trofotsoiittivaihe hyökkäyksen ja replikointi.
[Katso Huston, 2004 Tr. Parasitol. 20:23 tai Ralston ja Petri, 2011, Tr. Parasitol. 27: 253 katsauksia synnyssä.]
Kliiniset esittely
Amebiasis esittelee monenlaisia kliinisiä oireita (taulukko), joka vastaa potentiaalia E. histolytica tulla invasiivisia ja aiheuttaa etenevä sairaus. Itämisaika voi vaihdella muutamasta päivästä kuukausia tai vuosia 2-4 viikkoa on yleisin. Siirtymät yhdestä tyypistä suolen oireyhtymä toiseen voi tapahtua ja suoliston infektiot voivat aiheuttaa suoliston ulkopuolisten infektioita.
Suolistosairaus
Suoliston tauti
|
Suurin osa yksilöiden diagnosoitu E. histolytica (tai E. dispar) ei havaita mitään oireita tai joilla on epämääräinen ja epäspesifisiä vatsaoireista. Tämä tila voi jatkua tai edetä oireenmukaista infektio. Oireista nondysenteric infektioita esiintyy vaihteleva oireet vaihtelevat lievästä ja ohimeneviä intensiivistä ja pitkäkestoinen. Tyypillisiä oireita ovat: ripuli, kouristukset, ilmavaivat, pahoinvointi, ja ruokahaluttomuus. Ripuli usein vuorottelee aikoja ummetus tai pehmeä uloste. Ulosteet toisinaan sisältää limaa, mutta ei ole näkyvää verta.
Amebic punatauti alkaa yleensä hitaasti usean päivän vatsan kouristukset, tenesmi, ja satunnaiseterikois löysät ulosteet, mutta etenee ripuli verta ja limaa. Blood, limaa ja paloja nekroottisen kudoksen tulevat selvemmäksi määrä uloste kasvaessa (10-20 tai enemmän per päivä) ja ulosteet sisältävät usein vähän ulosteet. Muutamat potilaat voivat kehittyä kuume, oksentelu, vatsan arkuus tai nestehukka (erityisesti lapset), kun sairauden vakavuus kasvaa. Fulminantti tai grangrenous, colitus on harvinainen, mutta hyvin vakava muoto suoliston amebiasis. Potilailla esiintyy vakava verinen ripuli, kuume, ja hajanainen vatsan arkuus. Suurin osa limakalvo on mukana ja kuolleisuus on yli 50%. Krooninen amebiasis, jolle on ominaista toistuvat iskut punatauti kanssa välissä kausia lieviä tai kohtalaisia maha-suolikanavan oireet, voi myös esiintyä.
Amebomas läsnä kivuliaat vatsan massat, joita esiintyy yleisimmin umpisuoli ja nouseva paksusuoli. Ahtaumaoireita tai verenvuodot saattavat myös liittyä ameboma. Amebomas ovat harvinaisia ja voidaan sekoittaa karsinoomien tai kasvaimia. Peräaukon haavaumat ovat eräänlaista ihon amebiasis, jotka johtuvat suoraan leviäminen suoliston infektiota.
Amebic maksa paiseet ovat yleisin suoliston ulkopuolisten amebiasis. Puhkeamista Maksan oireet voivat olla nopea tai vähitellen. Maksan infektiot ovat ominaista hepatomegalia, maksan arkuus, kipu oikeassa yläkulmassa neljänneksessä, kuume ja ruokahaluttomuus. Kuume joskus tapahtuu päivittäin iltapäivällä tai illalla. Maksan toimintakokeet ovat yleensä normaali tai hieman poikkeava ja keltaisuutta on epätavallinen. Maksa paiseita ajoittain repeämä osaksi vatsakalvon tuloksena peritoniitti.
Keuhkojen amebiasis on yleensä johtuu suoraan myöntämistä maksan paise läpi kalvon. Kliiniset oireet useimmiten olla yskä, rintakipu, hengenahdistus (hengitysvaikeudet), ja kuume. Yskös voi olla märkivä tai verinen ja sisältävät trophozoites. Runsasta expectoration (eli vomica) on märkäeritettä voi myös esiintyä. Ensisijainen etäpesäkkeitä keuhkoihin on harvinainen, mutta tapahtuu. Samoin infektio muissa elimissä (esim., Aivot, perna, sydänpussin) on myös harvinaista. Kliiniset oireet liittyvät kyseinen elin.
Ihon amebiasis on seurausta ihon tai limakalvojen kylvetetään sisältävien nesteiden trophozoites. Tämä kosketus voi olla seurausta avanne (suolen, maksan, välilihan) tai hyökkäyksen sukuelinten. Ihovaurioihin on märkä, rakeinen, nekroottista pinta merkittävässä rajoja ja voi olla erittäin tuhoisa. Kliininen diagnoosi on vaikeaa ja yleensä harkita epidemiologiset riskitekijät (esim., Endeemisillä alueilla, miespuolinen homoseksuaalisuus, jne).
Diagnoosin, hoidon ja ohjaus
Lopullisen diagnoosin amebiasis edellyttää osoitus E. histolytica kystat tai trophozoites ulosteeseen tai kudoksissa. Ulostenäytteitä olisi säilytettävä ja värjätään ja mikroskooppisesti. Kystat on taipumus vallitsevia uloste ja trophozoites in Diarrhetic ulosteet (ks morfologia). Tuore uloste voidaan myös heti tutkitaan liikkuvien trophozoites joilla on etenevä liikkuvuutta. Sigmoidoskopia voi paljastaa ominaisuus haavaumia, varsinkin vakavampi tauti. Aspiraatit tai koepaloja olisi myös mikroskooppitutkimus trophozoites.
| Diagnoosin |
Suolistosairaus
Suoliston (maksan) tauti
|
E. histolytica ja E. dispar voida erottaa morfologisiin kriteereihin. Antigeeninosoituksella sarjat ovat saatavilla positiivinen tunnistus näiden lajien. Yksi tällainen nopea antigeenin havaitseminen testi on E. histolytica quik chek (TechLab, Inc).
Serologia on erityisen hyödyllinen diagnosoinnissa suoliston ulkopuolisten amebiasis. Suurempi kuin 90%: lla invasiivisia paksusuolentulehdus ja maksa paiseet näytteille seerumin vasta-aineita E. histolytica. Kuitenkin vasta-aineet voivat säilyä vuosia ja erottaa entisiä ja nykyisiä infektiot voivat aiheuttaa ongelmia endeemisillä alueilla. Ei-invasiiviset tekniikat (esim. Ultraääni, CT, MRI) voidaan käyttää havaitsemaan maksan paiseet. On myös mahdollista imeä maksan paiseet. Tämä on kuitenkin harvoin tehty ja ilmoitettu vain valikoiduissa tapauksissa (esim., Serologia ja kuvantaminen ei ole saatavilla, lääkkeenä). Aspirate on yleensä paksu punaruskea neste, joka harvoin sisältää trophozoites. Trophozoites todennäköisimmin löytyy paise seinää eikä nekroottisen roskat paise keskelle.
Useat lääkkeet ovat saatavilla hoitoon amebiasis ja valinta lääkkeen (s) riippuu kliinisessä vaiheessa infektio (taulukko). Ennuste käsittelyn jälkeen on yleensä hyvä lievien tapausten. Tapauksissa, joissa E. histolytica on vahvistettu tai lajin (eli dispar tai histolytica) on tuntematon, oireeton kysta ohikulkijoita tulisi käsitellä estämään eteneminen vakava sairaus ja valvoa taudin leviämisen. Kuitenkin monissa endeemisillä alueilla, joissa hinnat infektiosyklit ovat korkeat ja käsittely on kallista, standardi käytäntö on vain hoitoon oireisen tapauksissa. Metronidatsoli tai tinidatsolia (jos saatavilla) suositellaan kaikille oireenmukaista infektioita. Tämä hoito pitäisi seurata tai yhdistettynä luumenin antiamebic lääkkeiden kuvatulla oireettomilla potilailla.
Amebiasis hoito |
||||||||
|
Kun fulminanttia amemic paksusuolitulehdus tai rei’itys suolen seinämän laajan kirjon antibiootti voidaan myös käyttää hoitamaan suolistobakteerien vatsakalvon. Nekroottinen koliitti vaatii kiireellistä sairaalahoitoa palauttaa neste- ja elektrolyyttitasapainon. Lisäksi emetiini tai dehydroemetine joskus annetaan yhdessä nitroimidatsoli. Tämä tehdään vain kaikkein vaikeimmissa tapauksissa myrkyllisyyden vuoksi näiden lääkkeiden. Leikkaus voi myös olla tarpeen sulkea rei’ityksiä tai osittaista kolostomia. Paise tyhjene maksan vaurioiden (ts punktiomenetelmällä tai kirurgiset kuivatus) on nyt harvoin hoitotarkoituksiin ja on tarkoitettu vain tapauksissa suuria paiseita suurella todennäköisyydellä repeämä.
Ehkäisemisen ja toimenpiteet ovat samankaltaisia kuin muut sairaudet lähettämää ulosteiden-suun kautta (ks riskitekijät tai keskustelu Giardia ohjaus). Suurin ero on, että ihmiset ovat ainoa isäntä E. histolytica ja ei ole mahdollisuutta zoonoosien lähetyksen. Ohjaus perustuu vältetään saastuminen ruoan tai veden kanssa ulosteet. Terveysvalistus suhteen parantamiseen henkilökohtaiseen hygieniaan, terveys hävittäminen ulostetta, ja käsien pesu ovat erityisen tehokkaita. Suojeleminen vesihuoltoon alentaa endemisöityminen ja epidemioita. Kuten Giardia, Entamoeba kystat ovat resistenttejä standardin klooria hoitoon, vaan tapetaan jodi tai keittämällä. Sedimentaatio ja suodatus prosessit ovat varsin tehokkaita poistamaan Entamoeba kystat. Kemoprofylaksia ei suositella.
Katsauksia amebiasis:
- Haque, R. et al (2003) amebiasis. N. Engl. J. Med. 348: 1565.
- Stanley, S.L. (2003) ameebatauti. The Lancet 361: 1025.
Blastocystis hominis
Blastocystis hominis on yleinen organismi löydetty ihmisen ulosteet. Koska sen ensimmäinen kuvaus noin 100 vuotta sitten, se on vaihtelevasti luokiteltu ameba, hiiva, joka on itiöeläin ja kysta vaihe ruoskia. Analyysi pienen alayksikön rRNA-sekvenssi osoittaa, että blastocystis läheisimmin liittyy stramenopiles, monimutkainen kokoonpano unicellular ja muticellular protisteja. Muita stramenopiles sisältyvät piilevät, ruskolevät, ja vesi muotit. Monet ominaisuudet blastocystis ovat tuntemattomia tai kiistanalainen. Lähetystavasta, mekanismi solujen lisääntymisen, ja muut ominaisuudet elinkaaren ole lopullisesti osoitettu. Samoin tilan blastocystis kuin taudinaiheuttaja, kommensaali tai opportunistisia organismi ei tunneta.
On ollut useita raportteja viittaa blastocystis aiheuttaa sairauden, samoin kuin monet raporttien mukaan päinvastainen. Ripuli, kouristukset, pahoinvointi, oksentelu ja vatsakipu on liittynyt suuri määrä organismeja ulosteessa. Lisäksi jotkut tutkimukset ovat osoittaneet, että hoito lievittää oireita ja poistaa organismit. Kuitenkin käytetyt lääkkeet vastaan blastocystis (esim. Metronidatsoli) myös toimia vastaan monia muita suoliston alkueläimet ja bakteerit. Kyvyttömyys sulkea pois muita organismeja lähteenä oireita ja havainto, että monet tartunnan saaneet henkilöt näytteille mitään oireita vaikeuttaa tehdä lopullisia johtopäätöksiä synnyssä blastocystis. Lisäksi voi olla, että blastocystis on ensisijaisesti kommensaali, mutta voi esiintyä virulenssi tietyissä isäntä olosuhteissa, kuten samanaikainen infektioita, huono ravitsemus, tai immunosuppressio.
Blastocystis löytyy myös monenlaisia eläinten, mukaan lukien nisäkkäät, linnut, matelijat, sammakkoeläimet ja jopa hyönteisiä, ja sillä on laaja valikoima molekyyli- monimuotoisuutta. Geneettinen väli blastocystis isolaattien on suurempi kuin geneettinen etäisyys E. histolytica ja E. dispar (katso keskustelu E. dispar). Tämä hankaloittaa nimeäminen lajien ja historiallisesti ihmisen isolaatteja on nimetty B. hominis ja eristää muista isännät kuten blastocystis sp .. Kuitenkin fylogeneettistä analyysi paljastaa, että ei ole olemassa yksinomaan ihmisen clades ja ihmisen isolaatteja löytyy kaikissa clades. Tämä nostaa esiin mahdollisuuden, että blastocystis ei isäntä erityistä ja voidaan lähettää zoonotically. Lisäksi laaja geneettinen monimuotoisuus voidaan selittää kiistaa koskee patogeenisuutta blastocystis, että jotkut genotyypit voivat olla virulentteja kuin toiset. Kuitenkin tutkimukset tämän kysymyksen viittaavat siihen, että tämä ei pidä paikkaansa. Päätöslauselma hämmennystä taksonomian, siirto ja virulenssi blastocystis vaatii lisätutkimuksia.
Katsauksia blastocystis:
- Clark CG, van der Giezen M, Alfellani MA, Stensvold CR (2013) viimeaikainen kehitys blastocystis tutkimus. Edistysaskeleet parasitologian 82, 1-32.
- Scanlan PD (2012) blastocystis: menneisyys sudenkuopat ja tulevaisuudennäkymät. Suuntaukset parasitologian 28, 327-334.
- Tan KSW, Mirza H, Teo JDW, Wu B, Macary PA (2010) Nykyinen Näkemyksiä kliininen merkitys blastocystis spp. Nykyinen tartuntatauti raportit 12, 28-35.
Apatogeenisia commensals
Lukuisat alkueläimet voivat asuttavat ruoansulatuskanavan ihmisten. Useimmat näistä tapahtuu vähän tai ei lainkaan avointa patologian. Infektio näillä alkueläimiä on osoitus ulosteen saastumista ja riskin ilmaisevan enemmän vakavia infektioita, kuten Giardia tai E. histolytica. Näitä ei-patogeenisiä lajeja voidaan myös sekoittaa mahdollisesti patogeenisten Giardia tai E. histolytica ja johtaa tarpeettomaan lääkehoitoa. Lisäksi tällainen diagnosoida on myös ongelmallista, että todellinen syy oireet voivat jäädä huomaamatta ja asianmukaista hoitoa viivästyy.
- E. histolytica
- E. dispar
- E. coli
- E. hartmanni
- E. polecki
- E. gingivalis
- Muut entamoeba
- Muut suoliston amebae
- Muut suoliston siimalevistä
- Blastocystis
Entamoeba laji tarttumasta ihmisiin
Useat Entamoeba lajit tarttua ihmiseen (laatikko). E. histolytica aiheuttaa vakavan suolistosairaus ominaista punatauti sekä invasiivisen tauti pääasiassa maksassa (ks amebiasis). E. dispar on morfologisesti identtinen E. histolytica, mutta ei tuota invasiivisen sairauden (katso tarkemmin keskustelua E. dispar). Erottavan piirre Entamoeba on niiden ydin- morfologia, joka on kuvattu olevan reuna-chromatin ja pieni karyosome. E. histolytica/dispar, E. coli, ja E. hartmanni voidaan erottaa koon ja pieniä morfologisia eroja (katso taulukko).
| Suoliston Entamoeba Laji | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
*=E. histolytica; **invasiivisia E. histolytica voi olla> 20 mm |
E. coli on suurin ja parhaiten erottaa 8 ytimien kypsä kysta. Trophozoites E. coli voi olla vaikea erottaa E. histolytica / dispar sillä on jonkin verran päällekkäisyyttä kokoluokissa. E. hartmanni on melko samanlainen E. histolytica ja aiemmin pidetty “pieni kilpailu” E. histolytica. Yleensä 10 pm valitaan raja E. histolytica ja E. hartmanni.
E. polecki liittyy yleensä sikojen ja apinoilla, mutta ihmisen tapauksia on joskus dokumentoitu. Se näyttää maantieteellisesti rajattu tiettyihin tällaiseen Papua New Guinea. Trophozoites muistuttavat E. coli, paitsi hieman pienempi, ja kystat ovat samanlaisia E. histolytica paitsi että kypsä kysta on yksi ydin.
E. gingivalisista voidaan ottaa talteen pehmeän hammaskiven hampaiden väliin ja osoittaa samanlainen morfologia E. histolytica paitsi että sillä ei ole kysta vaiheessa. E. gingivalisista voi myös lisääntyä keuhkoputkien limaa, ja siten voi näkyä ysköksen. Tässä tapauksessa se voitaisiin sekoittaa E. histolytica peräisin keuhkojen paise. E. gingivalis trophozoites usein sisältävät nautittuina leukosyyttien, joita voidaan käyttää sen erottamiseksi E. histolytica. Trophozoites useimmiten talteen potilaalla on parodontiitin, mutta etiologia välillä organismin ja tautia ei ole vahvistettu, ja E. gingivalisista katsotaan olevan ei-patogeeninen.
Muut suoliston amebae
Muut ei-patogeeninen amebae sisältävät Endolimax nana ja Iodoamoeba bütschlii. Historiallisesti, Dientamoeba fragilis on ryhmitelty ameba, mutta elektronimikroskoopilla ja molekyylien phylogenetics viittaa siihen, että se on todella siimalevä ja voidaan läheistä sukua Trichomonads (katso edellä). Kaikki nämä kolme organismien osoittavat samankaltaisia morfologioita ja on ytimet, joilla ei ole reuna chromatin ja suuri karyosome. Minor morfologiset erot sallivat näiden organims erotettava (taulukko).
| Muut Suoliston Amebae | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
* Ruoskia mahdollisesti liittyviä Trichomonads. |
Muut suoliston siimalevistä
Neljä ylimääräistä apatogeenisia siimalevistä talteen ihmisen ulosteet ovat: Trichomonas hominis, Chilomastix mesnili, Enteromonas hominis, ja Retortamonas intestinalis. Näistä T. hominis, jota kutsutaan myös Pentatrichomonas hominis, on yleisin ja se on usein talteen Diarrhetic ulosteet. Nämä siimalevistä osoittavat samankaltaisia morfologit (taulukko) ja voi olla vaikea erottaa. Trophozoites kaikista näistä siimaleviä ovat hieman pisaran muotoinen ja sisältää yhden tumaan ja kysta yleensä hieman pitkänomainen tai soikea.
| Muut Suoliston siimalevistä | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||

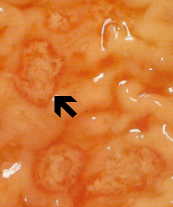
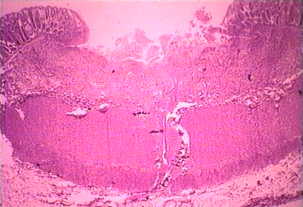
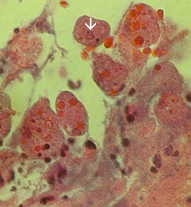
Comments are closed, but trackbacks and pingbacks are open.